
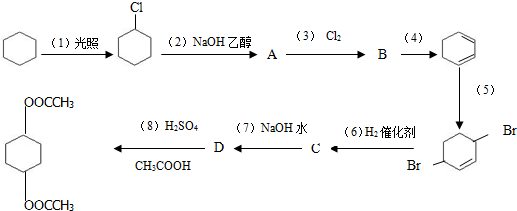
 ,A与氯气发生加成反应生成B为
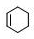
,A与氯气发生加成反应生成B为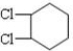 ,B在NaOH/醇条件下发生消去反应生成1,3-环己二烯,反应(5)发生为1,4-加成反应,反应(6)为碳碳双键与氢气发生加成反应生成C为
,B在NaOH/醇条件下发生消去反应生成1,3-环己二烯,反应(5)发生为1,4-加成反应,反应(6)为碳碳双键与氢气发生加成反应生成C为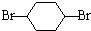 ,C在NaOH水溶液、加热条件下发生水解反应生成D为
,C在NaOH水溶液、加热条件下发生水解反应生成D为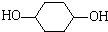 ,反应(8)为醇与乙酸的酯化反应,据此解答.
,反应(8)为醇与乙酸的酯化反应,据此解答. ,A与氯气发生加成反应生成B为
,A与氯气发生加成反应生成B为 ,B在NaOH/醇条件下发生消去反应生成1,3-环己二烯,反应(5)发生为1,4-加成反应,反应(6)为碳碳双键与氢气发生加成反应生成C为
,B在NaOH/醇条件下发生消去反应生成1,3-环己二烯,反应(5)发生为1,4-加成反应,反应(6)为碳碳双键与氢气发生加成反应生成C为 ,C在NaOH水溶液、加热条件下发生水解反应生成D为
,C在NaOH水溶液、加热条件下发生水解反应生成D为 ,反应(8)为醇与乙酸的酯化反应,
,反应(8)为醇与乙酸的酯化反应, ,
, ;
; ,
, ;
;


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入碘水变蓝 |
| B、加入氯化铁溶液变蓝 |
| C、加入AgNO3溶液产生黄色沉淀 |
| D、加入氯水变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
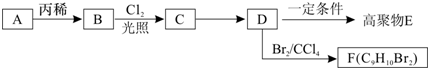
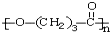 ),它可代替高聚物E,以减少“白色污染”.
),它可代替高聚物E,以减少“白色污染”.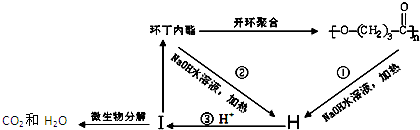
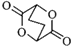
 ⅱ、
ⅱ、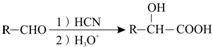
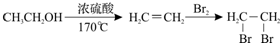
查看答案和解析>>
科目:高中化学 来源: 题型:
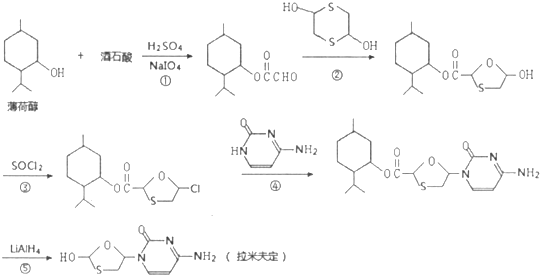
| HIO4 |
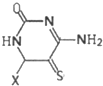 (其中X表示剩余的部分)
(其中X表示剩余的部分)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com