
【题目】如图所示甲、乙为相互串联的两电解池.试回答: 
(1)甲池若为用电解原理精炼铜的装置,则A电极名称为极,电极材料是 , 电极反应式为 .
(2)乙池中C(石墨)极电极反应式为 , 若在乙池中滴入少量酚酞试液,电解一段时间后,铁极附近呈色.
(3)若甲池A极增重1.28g,则乙池Fe极放出的气体在标况下的体积为 . 电解后,若乙池剩余溶液为400mL,则溶液的pH= .
【答案】
(1)阴;精铜(或纯铜); Cu2++2e﹣=Cu
(2)2Cl﹣﹣2e﹣═Cl2↑;红
(3)0.448L;13
【解析】解:(1)电解精炼的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液(CuSO4溶液或CuCl2溶液)进行电解反应,在阴极是溶液中铜离子得到电子生成铜,电极反应是Cu2++2e﹣═Cu,
所以答案是:阴;精铜(或纯铜); Cu2++2e﹣=Cu;(2)依据装置图分析可知,与电源正极相连的C电极为电解池的阳极,电极反应为:2Cl﹣﹣2e﹣═Cl2↑;Fe电极上是溶液中氢离子得到电子生成氢气,电极反应为2H++2e﹣═H2↑,破坏水的电离平衡氢氧根离子浓度增大,铁电极附近溶液变红色,
所以答案是:2Cl﹣﹣2e﹣═Cl2↑;红; (3)甲池A为电解池的阴极,电极反应为Cu2++2e﹣═Cu,增重1.28g的铜物质的量为0.02mol,转移电子物质的量为0.04mol;
乙池Fe电极上是溶液中氢离子得到电子生成氢气,电极反应为2H++2e﹣═H2↑,依据电子守恒,生成氢气0.02mol,放出气体在标况下的体积为0.02mol×22.4L/mol=0.448L,依据水的电离氢离子和氢氧根离子守恒得到,生成氢氧根离子物质的量为0.04mol,c(OH﹣)= ![]() =0.1mol/L,溶液pH=13;
=0.1mol/L,溶液pH=13;
所以答案是:0.448L;13.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关第VI A族元素氧、硫、硒的说法正确的是
A.氧、硫、硒三种元索的最高正化合价均为+6B.氢化物的稳定性:H2O>H2S>H2Se
C.氢化物的还原性:H2O>H2S>H2SeD.单质的熔点:O2>S>Se
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O主要用于制造船底防污漆,它是一种鲜红色粉末,几乎不溶于水,在湿空气中逐渐氧化成黑色氧化铜。用含NaOH的Na2SO3溶液还原CuSO4制备Cu2O的工艺流程如下:

回答下列问题:
(1)流程中涉及的化学反应主要包括:
Ⅰ.Cu2++2OH-=Cu(OH)2↓;Ⅱ.生成CuOH;Ⅲ.2CuOH=Cu2O+H2O。
写出第Ⅱ步反应的离子方程式: ______________________________。
(2)其他反应条件相同时,测得反应时间和溶液的pH对Cu2O产率的影响如下图所示:
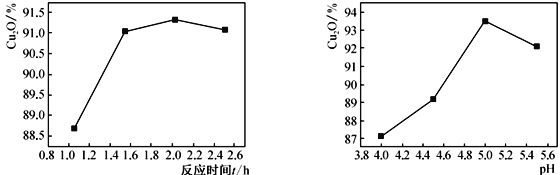
①反应时间超过2h时,Cu2O产率开始降低其原因是____________________________。
②pH<5时,Cu2O产率随pH减小而减小,产品中铜含量增加明显,其原因是______________________(用离子方程式说明)。
(3)为测定产品中Cu2O的含量,称取3.96 g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,至终点时消耗50mL标准液。
①滴定时应选用______(填“酸式”或“碱式”)滴定管,滴定终点的现象是______________________。
②产品与硫酸酸化的Fe2(SO4)3溶液反应的离子方程式为________________________________。
③假定杂质不参与反应,产品中Cu2O的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)在25℃时,若100体积的某强酸溶液与1体积的某强碱溶液混合溶液中性,则混和前强酸pH1和强碱pH2应该满足的关系是pH1+pH2=
(2)某温度(t℃)时,水的离子积Kw=10﹣12 , 则该温度(填大于、小于或等于)25℃.将此温度下,将pH=2的硫酸溶液V1L与pH=11的氢氧化钠溶液V2L混合: ①若所得混合液为中性,则V1:V2= .
②若所得混合液的pH=10,则V1:V2= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质生产工艺的设计,必须牢牢抓住物质的性质,而推断化合物的化学性质,常从两个角度Ⅰ、物质的属类(如氧化物、酸、碱或盐等);Ⅱ、组成元素的化合价(是否处于最高价、中间价态或最低价)。请回答2
(1)已知SiO2是一种难溶于水的酸性氧化物,试写出一个化学方程式表示该物质具有的化学性质:__________________________________;
(2)已知,黄铜矿冶炼铜产生的炉渣含有Fe2O3、FeO、SiO2、Al2O3等多种氧化物,工业生产过程中可利用该炉渣制备Fe2O3。利用炉渣制备氧化铁的生产流程示意图如下:
![]()
①若盐酸浸泡后所得滤液用氯气处理,反应的离子方程式为______________________;经“足量的NaOH溶液”处理后,存在于炉渣中的铝元素最终以_____________形式被除去。
A.Al B.Al(OH)3 C.Al3+ D.[Al(OH)4]—
②现有a、稀硫酸 b、HNO3溶液 c、KSCN溶液 d、KMnO4溶液 e、NaOH溶液 f、碘水等试剂,为检验原炉渣中是否含有FeO,应该选择上述试剂中的_________________(填试剂对应的字母)。若存在FeO,将观察到的现象是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如下图所示。下列说法不正确的是( )

A. B为电源的负极
B. 阳极室中发生的反应依次为:2Cl--2e-=Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
C. 电解结束后,阴极室溶液的pH与电解前相比一定会减小
D. 若两极共收集到气体13.44 L(标准状况),则理论可去除尿素为7.2g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6mol铜粉投入含8mol硝酸和2mol硫酸的稀溶液中,则标准状况下放出的气体的物质的量为( )
A.2 mol
B.3 mol
C.4 mol
D.5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com