
【题目】(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为___,c(N2O5)为___,O2的物质的量浓度为___。
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为___,c(N2O5)为___,O2的物质的量浓度为___。
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:
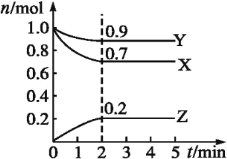
①该反应的化学方程式为___。
②反应至平衡时,v(X)为___,c(Z)为___。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时___(填“增大”“减小”或“相等”)。
【答案】0.16mol·L-1·min-1 1.6mol·L-1 0.2mol·L-1 3X+Y![]() 2Z 0.375mol·L-1 0.1mol·L-1 增大
2Z 0.375mol·L-1 0.1mol·L-1 增大
【解析】
(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则参加反应的五氧化二氮的物质的量=4mol×20%=0.8mol,则:
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则参加反应的五氧化二氮的物质的量=4mol×20%=0.8mol,则:

υ(NO2)=![]() =0.16mol·L-1·min-1 ;
=0.16mol·L-1·min-1 ;
c(N2O5)=![]() =1.6mol·L-1 ;
=1.6mol·L-1 ;
c(O2)=![]() =0.2mol·L-1 ;
=0.2mol·L-1 ;
故答案为:0.16mol·L-1·min-1 ; 1.6mol·L-1 ; 0.2mol·L-1;
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:
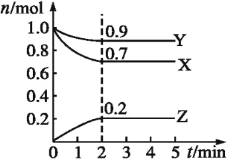
①X、Y的物质的量减小,为反应物,Z的物质的量增大为生成物,最终X、Y的物质的量不变,且不为0,属于可逆反应,X、Y、Z的化学计量数之比=(1-0.7):(1-0.9):0.2=3:1:2,故反应方程式为3X+Y![]() 2Z。故答案为:3X+Y
2Z。故答案为:3X+Y![]() 2Z;
2Z;
②反应至平衡时,v(X)=![]() =0.375mol·L-1,c(Z)=
=0.375mol·L-1,c(Z)=![]() =0.1mol·L-1。故答案为:0.375mol·L-1;0.1mol·L-1;
=0.1mol·L-1。故答案为:0.375mol·L-1;0.1mol·L-1;
③若X、Y、Z均为气体,则达平衡时,混合气体总的质量不变,随反应进行,混合气体总的物质的量减小,结合M=![]() 可知,容器内混合气体的平均相对分子质量比起始投料时增大。故答案为:增大。
可知,容器内混合气体的平均相对分子质量比起始投料时增大。故答案为:增大。


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g46%甲酸(HCOOH)水溶液所含的氧原子数为5NA
B. 标准状况下,18g冰水中共价键的数目为NA
C. 56g铁与71gCl2充分反应,转移电子数目为3NA
D. 7.8gNa2O2与足量的水(H218O)反应生成的氧气所含的中子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO)制备草酸镍晶体(NiC2O4·2H2O)的流程如下:

(1)NiC2O4·2H2O中C的化合价是______。既能加快“酸浸”反应速率又能提高“酸浸”原料利用率的操作措施为_____________。
(2)“滤渣Ⅰ”的主要成分是_____________。若控制温度为80℃、pH=2时,“除铁”产生的“滤渣Ⅱ”的主要成分为黄钠铁矾(Na2Fe6(SO4)4(OH)12),写出生成黄钠铁矾沉淀的离子方程式:__________________。
(3)已知“滤渣Ⅲ”的主要成分为CaF2,则“萃取”操作中加入有机萃取剂的作用是__________。
(4)在隔绝空气的条件下,高温煅烧无水NiC2O4得到Ni2O3和两种含碳元素的气体,该反应的化学方程式是_________。
(5)高能锂离子电池的总反应为2Li + FeS = Fe + Li2S。用该电池作电源电解含镍酸性废水回收Ni的装置如图(图中X、Y为电极,LiPF6·SO(CH3)2为电解质)。

①电极X的反应材料是_________(填化学式);中间隔室b可以得到的主要物质Z是_________(填化学式)。
②电解总反应的离子方程式为_________。已知F=96500C/mol,若电池工作t min,维持电流强度为I A,理论回收Ni_________g(写出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
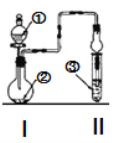
① | ② | ③ | II中实验现象 | |
A | 浓盐酸 | 大理石 | 氯化钡溶液 | 产生大量白色沉淀 |
B | 浓氨水 | 碱石灰 | 硫酸亚铁溶液 | 产生大量白色沉淀 |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 |
D | 浓盐酸 | KMnO4 | 氢硫酸 | 产生淡黄色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因存在浓度差而产生电动势的电池称为浓差电池。利用如图所示装置进行实验,开始先闭合K2,断开Kl,电解一段时间后,再断开K2,闭合Kl,形成浓差电池,电流计指针偏转(Ag+浓度越大,氧化性越强)。下列说法不正确的是
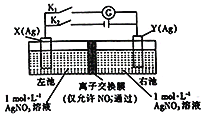
A.闭合K2,断开Kl,NO3-从左池向右池移动
B.断开K2,闭合K1,X为正极
C.闭合K2,断开Kl一段时间后,右池c(AgNO3)增大
D.装置安装后若直接闭合Kl,电流计指针不发生偏转,但往左池加入适当的氨水后,指针偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可用已知浓度的标准I2溶液进行滴定(弱酸性性环境)。该反应的化学方程式为:C6H8O6+I2 = C6H6O6+2HI具体测定步骤及测得数据如下:取10 mL 6 mol·L-1CH3COOH溶液,加入100 mL蒸馏水,将溶液加热煮沸后冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中,加入1mL指示剂,立即用浓度为0.0500 mol·L-1的标准I2溶液进行滴定到终点,消耗21.00 mL I2溶液。
(1)实验中的指示剂是____________确定达到滴定终点的现象是_____________。
(2)盛装标准I2溶液的是_________(酸式或碱式)滴定管,若滴定结束时俯视滴定管读数(其它操作正确)则滴定结果_______(偏高、偏低或无影响)。
(3)加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用,其目的是_____________。
(4)计算样品中维生素C的质量分数____________(要求列式,且式中各物理量带单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分解水制氢的一种原理如图,下列关于该原理的说法正确的是( )

A.反应过程中化合价改变的元素共有H、O、S
B.涉及的反应类型有分解反应和化合反应,且步骤Ⅲ是HI的分解
C.理论上,每生成16gO2,就能得到标准状况下22.4LH2
D.理论上,每分解18gH2O,就需向体系内再补充32gSO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
A | B | C | |||||||||||||||
D | E | F | G | H | I | J | K | ||||||||||
M |
(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)以A的最简单氢化物为燃料,D的最高价氧化物对应水化物为电解质溶液的燃料电池,其负极电极反应式为_____
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
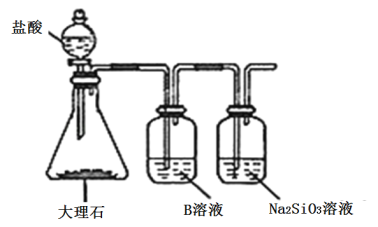
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com