
| A. | Mg(OH)2+2HCl═MgCl2+2H2O | B. | 2NaOH+H2SO4═Na2SO4+2H2O | ||
| C. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
分析 离子方程式H++OH-=H2O表示可溶性强碱与强酸反应生成可溶性盐和水的一类反应,据此进行解答.
解答 解:A.氢氧化镁为难溶物,离子方程式中氢氧化镁不能拆开,该反应不能用H++OH-=H2O表示,故A错误;
B.2NaOH+H2SO4═Na2SO4+2H2O的离子方程式为:H++OH-=H2O,故B正确;
C.Ba(OH)2+H2SO4═BaSO4↓+2H2O的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,不能用H++OH-=H2O表示,故C错误;
D.CH3COOH为弱酸,离子方程式中不能拆开,该反应不能用H++OH-=H2O表示,故D错误;
故选B.
点评 本题考查了离子方程式的书写,题目难度不大,明确离子方程式表示的意义为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的规范答题能力.


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 实验室制大量CO2 | 向石灰石中加入稀硫酸 |
| B | 证明某溶液中含有SO42- | 向该溶液中滴入BaCl2溶液 |
| C | 配制0.1mol/L CuSO4溶液 | 把2.5g胆矾晶体溶于水配成100mL溶液 |
| D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电泳现象可说明胶体带电荷 | |
| B. | 胶体粒子很小,可以透过半透膜 | |
| C. | 直径在1-100nm之间的粒子称为胶体 | |
| D. | 是否具有丁达尔效应是溶液与胶体的本质区别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍,四种溶液的pH为:①>②>③>④ | |
| B. | 温度上升10℃,四种溶液的pH不变 | |
| C. | ③④中分别加入适量的氯化按晶体后,③的pH减小,④的pH不变 | |
| D. | 将①④两种溶液等体积混合,所得溶液中c (C1-)>c NH4+)>c (H+)>c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
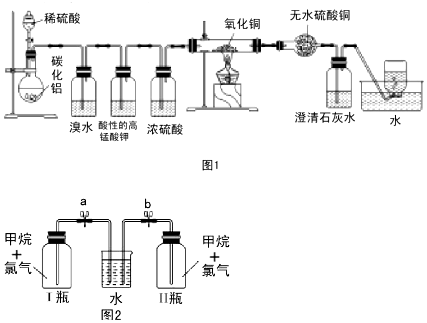
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
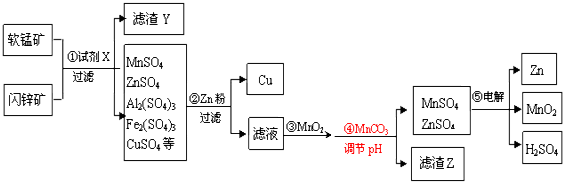
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com