
| A. | ①④ | B. | ②③ | ||
| C. | ①② | D. | ③④ | ||
| E. | 故①②可能,答案选C. |
分析 根据某溶液中离子只有Na+、CH3COO-、H+、OH-四种,离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则溶液显酸性,溶质不可能只有醋酸钠,则溶质可能为醋酸钠与醋酸,然后利用酸碱混合来分析溶液中的溶质即可解答.对于该溶液中加入碱,离子的浓度关系仍然遵循电荷守恒关系,则不会阴离子浓度都比阳离子浓度大.
解答 解:①pH=3的CH3COOH与pH=11的NaOH溶液等体积混合,由于乙酸的物质的量远大于氢氧化钠,得到的溶液显酸性,故①可能;
②0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,生成了等浓度的乙酸和乙酸钠溶液,乙酸电离大于乙酸钠的水解,溶液显酸性,故②可能;
③0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,两溶液恰好完全反应,生成乙酸钠溶液水解显碱性,故③不可能;
④0.1mol/L的CH3COONa溶液,乙酸钠水解显碱性,故④不可能;
故①②可能,
故选C.
点评 本题考查酸碱混合后溶液中离子浓度的关系,明确酸碱混合后溶液中的溶质是解答的关键,并学会利用电荷守恒及盐类水解规律来分析溶液中的离子浓度的关系,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | c(Fe3+)=1 xl0-5 mol•L-1 | |
| B. | 加水稀释,平衡①向右移动 | |
| C. | 加入等体积0.2 mol•L-1KSCN溶液,溶液变为血红色 | |
| D. | 加入等体积0.2 mol•L-1CaCl2溶液,可产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都能发生水解反应,但水解产物不同 | |
| B. | 25℃、lOlkPa时,2.24LCH4含有的共价键数为0.4NA | |
| C. | 56g聚乙烯中含有碳碳双键的数目为2键 | |
| D. | 2.8g硅单质与足量氧气在高温下完全反应时,硅原子失去的电子数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
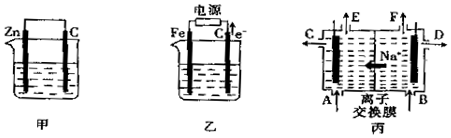
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、CO32-、Na+ | B. | NO3-、Ba2+、K+、Cl- | ||
| C. | Al3+、Ba2+、Mg2+、HCO3- | D. | NO3-、K+、SO32-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在pH=10.3时,溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)+c(Cl-) | |
| B. | 在pH=8.3时,溶液中:0.1000>c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | 在pH=6.3时,溶液中:c(Na+)>c(Cl-)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | V1:V2=1:2时,c(OH-)>c(HCO3-)>c(CO32-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油主要是烷烃、环烷烃或芳香烃等组成的混和物 | |
| B. | 石油经常压分馏得到的汽油是混合物,但石油气为纯净的丙烷 | |
| C. | 为了提高汽油等轻质油的产量,可以重油为原料进行催化裂化 | |
| D. | 石油的减压分馏可以得到重柴油、润滑油、石蜡、燃料油等馏分 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
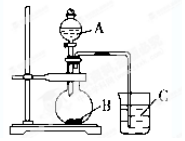 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
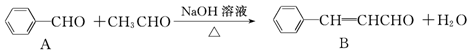
| A. | ①②⑤ | B. | ③④⑤ | C. | ④⑤⑥ | D. | ③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com