
| A.2.33×10-4 | B.1×10-5 | C.1×10-10 | D.1×10-12 |
科目:高中化学 来源:不详 题型:单选题
| A.c(X-)>c(Y-) |
| B.电离程度:HX>HY |
| C.HY溶液的pH值>HX溶液的pH |
| D.HY溶液中的c(H+)>HX溶液中的c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
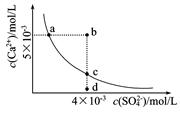
| A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 |
| B.a点对应的Ksp不等于c点对应的Ksp |
| C.b点将有沉淀生成 |
| D.向d点溶液中加入适量CaCl2固体可以变到c点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g);ΔH<0,则该反应一定能自发进行 |
| B.提取海带中碘元素时,为将I-完全氧化为I2,用HNO3作氧化剂比用H2O2效果好 |
| C.原电池放电过程中,负极质量一定减轻,正极的质量一定增加 |
| D.由于Ksp(MgCO3)<Ksp[Mg(OH)2],因此水垢中MgCO3会逐渐转化为Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小 |
| B.溶度积常数Ksp只受温度影响,温度升高Ksp减小 |
| C.溶度积常数Ksp只受温度影响,温度升高Ksp增大 |
| D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | AgCl | AgI | Ag2S |
| Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.AgCl(s) Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
B.Na2S 2Na++S2- 2Na++S2- |
C.Ag2S(s) 2Ag+(aq)+S2-(aq) 2Ag+(aq)+S2-(aq) |
D.PbI2(s) Pb2+(aq)+2I-(aq) Pb2+(aq)+2I-(aq) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
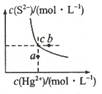
| A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小 |
| B.图中a点对应的是饱和溶液 |
| C.向c点的溶液中加入Hg(NO3)2,则c(S2-)减小 |
| D.升高温度可以实现c点到b点的转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com