
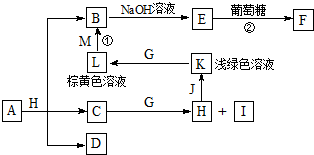
 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板.
各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷线路板. .
.分析 X在周期表中的原子半径最小,为H元素,Y、Z原子最外层电子数之和为10,“X、Y、Z的原子序数依次增大”,进而推出D(由H、C、O中的两种元素组成;无色非可燃性气体)为CO2,可以知道X、Y、Z是H、C、O,则C为H2O,H为HCl,I有漂白作用,应为HClO,浅绿色、棕黄色溶液为Fe2+和Fe3+,可知J为Fe,K为FeCl2,L为FeCl3,G为黄绿色单质气体,应为Cl2,反应①用于制作印刷电路板为FeCl3和Cu,则M为Cu,B为CuCl2,E能与葡萄糖反应,应为Cu(OH)2,F为Cu2O,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,应为CuCO3或Cu2(OH)2CO3或Cu(OH)2•CuCO3,A中包含X、Y、Z元素,A的化学式为Cu2(OH)2CO3或Cu(OH)2•CuCO3,据此回答.
解答 解:X在周期表中的原子半径最小,为H元素,Y、Z原子最外层电子数之和为10,“X、Y、Z的原子序数依次增大”,进而推出D(由H、C、O中的两种元素组成;无色非可燃性气体)为CO2,可以知道X、Y、Z是H、C、O,则C为H2O,H为HCl,I有漂白作用,应为HClO,浅绿色、棕黄色溶液为Fe2+和Fe3+,可知J为Fe,K为FeCl2,L为FeCl3,G为黄绿色单质气体,应为Cl2,反应①用于制作印刷电路板为FeCl3和Cu,则M为Cu,B为CuCl2,E能与葡萄糖反应,应为Cu(OH)2,F为Cu2O,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,应为CuCO3或Cu2(OH)2CO3或Cu(OH)2•CuCO3,A中包含X、Y、Z元素,A的化学式为Cu2(OH)2CO3或Cu(OH)2•CuCO3,
(1)G为Cl2,G元素在周期表中的位置是第三周期第ⅤⅡA族,C为H2O,C的电子式为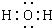 ,
,
故答案为:第三周期第ⅤⅡA族;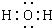 ;
;
(2)Y与Z分别是C、O,依据铜周期原子半径依次减小判断,C、O的原子半径C>O;
故答案为:C O;
(3)E为Cu(OH)2,E和乙醛反应的化学反应方程式为 CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,反应类型为氧化反应,
故答案为:CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O;氧化反应;
(4)实验室用浓盐酸与二氧化锰反应制备氯气,反应的离子反应方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O;
(5)D为CO2,CO2与NaOH溶液反应可生成两种盐为NaHCO3和Na2CO3,在Na2CO3中Na的质量分数为43%,其俗名为苏打,
故答案为:苏打;
(6)L为FeCl3,实验室中检验L溶液中的阳离子常选用KSCN溶液,现象是溶液出现血红色,
故答案为:KSCN溶液;溶液出现血红色;
(7)根据上面的分析可知,A的化学式为Cu2(OH)2CO3或Cu(OH)2•CuCO3,
故答案为:Cu2(OH)2CO3或Cu(OH)2•CuCO3;
(8)CO2可以还原成正四面体结构的晶体N,即化合价降低,显然生成了金刚石,它的同素异形体必须为含碳的单质,同素异形体的名称为:石墨、富勒烯(C60);
故答案为:金刚石;石墨或富勒烯(C60).
点评 本题综合考查无机框图物质的推断,考查了化学用语、元素化合物等知识点.该题主要以金属Cu、Fe、Cl2及化合物知识为载体考查了化学用语,仔细斟酌不难发现Cu2O与稀硝酸反应方程式的书写,有机物知识的渗透,并不是简单寻找与合并的过程,而是实现知识迁移,考查学生发散能力的过程,题目难度角较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 反应方程式 |
| 1.将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为橙色 | 离子方程式: Cl2+2Br-=Br2+2 Cl- |
| 1.将少量溴水加入盛有NaI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 上层为浅黄色(或无色) 下层为紫红色 | 化学方程式: Br2+2NaI=I2+2NaBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃和l00℃时H2O的KW | |
| B. | 同温同浓度的KHCO3溶液和NH4HCO3,溶液中的c(HCO3-) | |
| C. | 同温同浓度的NaHCO3溶液和CH3COONa溶液的pH | |
| D. | 中和25mL0.1mol/L NaOH溶液所需CH3COOH和HCl的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
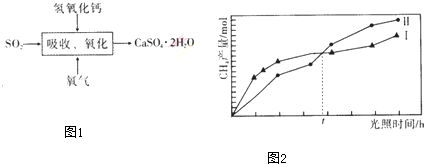
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
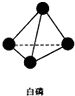 ,并指出1mol白磷(P4)含有P-P键的数目6NA
,并指出1mol白磷(P4)含有P-P键的数目6NA查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: | B. | CH4分子的比例模型: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 1,2-二甲基丁烷的结构简式为: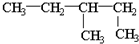 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的醋酸溶液稀释10倍后,其pH=b,则b=a+1 | |
| B. | 浓度相同的①NH4Cl;②CH3COONH4;③NH4HSO4三种溶液的c(NH4+):①>③>② | |
| C. | 浓度相同的氨水与盐酸等体积混合:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 将amol•L-1CH3COOH与bmol•L-1NaOH溶液等体积混合,测得溶液pH为7,则a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com