
(10分)(I)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水可以生成Zn(NH3)42+。回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式 。
(2)写出可溶性铝盐与过量氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
(II)环境专家认为可以用金属镁将水体中的NO 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH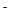 、Mg(OH)2、NO
、Mg(OH)2、NO 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(10分)(I)(1)Zn+2NaOH═Na2ZnO2+H2↑[或Zn+2NaOH+2H2O═Na2Zn(OH)4+H2↑](2分)
(2)Al3++3NH3·H2O═Al(OH)3↓+3NH4+(2分)
可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成Zn(NH3)42+,氨水的用量不易控制(2分)
(II) NO +Mg +H2O→Mg(OH)2+N2+OH-(2分)(不用配平,若配平不扣分,但配错不得分) 5:2(2分)
+Mg +H2O→Mg(OH)2+N2+OH-(2分)(不用配平,若配平不扣分,但配错不得分) 5:2(2分)
解析试题分析:本题给出的信息“锌的氢氧化物既能溶于强酸,又能溶于强碱。氢氧化锌溶于氨水可以生成Zn(NH3)42+。”学生没有学过,考查学生接受信息、处理信息的能力。
(1)锌与氢氧化钠反应可以类比铝与氢氧化钠反应:2Al+2H2O+2NaOH==2NaAlO2+3H2↑,则锌也生成类似的Na2ZnO2,所以方程式写成Zn+2NaOH═Na2ZnO2+H2↑[或Zn+2NaOH+2H2O═Na2Zn(OH)4+H2↑]
(2)因为氢氧化铝只能溶于强酸和强碱溶液,不能溶于弱酸和弱碱,所以铝盐与氨水只能生成氢氧化铝沉淀,不能与氨水继续反应。
(3)利用信息“金属镁将水体中的NO 转化为N2”可以判断硝酸根离子是氧化剂、还原剂只能是镁,氧化产物是Mg(OH)2,还原产物是N2。写出初步反应物和生成物:
转化为N2”可以判断硝酸根离子是氧化剂、还原剂只能是镁,氧化产物是Mg(OH)2,还原产物是N2。写出初步反应物和生成物:
NO +Mg →Mg(OH)2+N2,根据原子守恒,则反应物中有H2O,生成物中有OH-,再根据化合价升降相等,被氧化的Mg元素与被还原的N元素物质的量之比为5:2。
+Mg →Mg(OH)2+N2,根据原子守恒,则反应物中有H2O,生成物中有OH-,再根据化合价升降相等,被氧化的Mg元素与被还原的N元素物质的量之比为5:2。
考点:考查铝与碱、氢氧化铝与弱碱反应的方程式书写,考查学生对氧化还原反应中的基本概念的理解。
点评:题干中出现学生在高中没有学习的知识点,一般要考查学生的自学能力,在短时间内接受新信息、运用所学知识结合新信息处理问题的能力,此时只要我们认真读题,同时回忆已学习的知识与之的联系,往往这样的题起点高,落点不高,属于中等难度。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
下表中,对陈述 I、II的正确性及两者间有无因果关系的判断都正确的是( )
|
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建安溪一中、养正中学高三上学期期中联考化学试卷(解析版) 题型:填空题
(10分)(I)锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,氢氧化锌溶于氨水可以生成Zn(NH3)42+。回答下列问题:
(1)写出锌和氢氧化钠溶液反应的化学方程式 。
(2)写出可溶性铝盐与过量氨水反应的离子方程式 。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因 。
(II)环境专家认为可以用金属镁将水体中的NO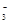 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Mg、OH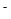 、Mg(OH)2、NO
、Mg(OH)2、NO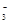 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。

该反应过程中,被氧化与被还原的元素的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2013届安徽省高二上学期期末考试化学A卷(解析版) 题型:选择题
下表中,对陈述I、II的正确性及两者间有无因果关系的判断都正确的是
|
选项 |
陈述I |
陈述II |
判断 |
|
A |
用锌和足量稀硫酸制取氢气时加入硫酸铜溶液 |
可以制取更多的氢气 |
I对、II对、有 |
|
B |
用Mg—Al—NaOH构成原电池 |
Mg更活泼作负极 |
I对、II对、无 |
|
C |
AlCl3是离子化合物 |
电解熔融的AlCl3制取金属铝 |
I对、II对、无 |
|
D |
石墨常用做电解池的电极 |
石墨的化学性质稳定且导电性好 |
I对、II对、有 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省六安三中高二上学期期末考试化学A卷(带解析) 题型:单选题
下表中,对陈述I、II的正确性及两者间有无因果关系的判断都正确的是
| 选项 | 陈述I | 陈述II | 判断 |
| A | 用锌和足量稀硫酸制取氢气时加入硫酸铜溶液 | 可以制取更多的氢气 | I对、II对、有 |
| B | 用Mg—Al—NaOH构成原电池 | Mg更活泼作负极 | I对、II对、无 |
| C | AlCl3是离子化合物 | 电解熔融的AlCl3制取金属铝 | I对、II对、无 |
| D | 石墨常用做电解池的电极 | 石墨的化学性质稳定且导电性好 | I对、II对、有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com