
下图中甲、乙、丙的电极材料都是石墨和铁,其中丙是氯碱工业生产示意图。
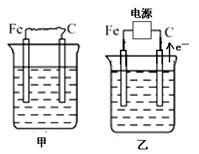
(1)若甲、乙两烧杯均盛放CuSO4溶液,
①甲中铁棒上的电极反应式为_______________________________________。
②乙装置工作一段时间后,向烧杯中加入适量的碱式碳酸铜【Cu2(OH)2CO3】,能使溶液恢复到起始状态,请写出这段时间内乙装置发生的所有反应的化学方程式
________________________________________________________________________。
(2)若甲、乙两烧杯均盛放饱和NaCl溶液,
①甲中石墨棒上的电极反应式为___________________。
②将湿润的淀粉碘化钾试纸放在乙烧杯______(填“Fe”或“C”)电极的上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应物Cl2和I2的物质的量之比为5∶1,且生成两种酸,则其对应的化学方程式为_________________________。
③假设产生的气体全部逸出溶液,当乙反应有0.01 mol电子转移后停止实验,此时烧杯中溶液的体积为100 mL,则溶液混合均匀后的pH = ____________。
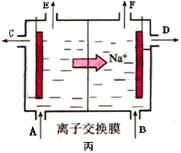
④当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常使用如丙图所示的装置,其中离子交换膜只允许Na+通过,Na+的移动方向如图中标注,则H2的出口是________(填代号)。
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:阅读理解

| 序号 | 实验内容要点 | 实验现象, | 结论及解释 | ||||
| (1) | 加热后,缓慢通气体 | E中澄清石灰水不变浑浊,G中澄清石灰水变浑浊 | 猜想 ① ① 成立 | ||||
| (2) | 将D装置取走,连接好其余装置, 继续反应 |
观察到E中澄清石灰水始终不 变浑浊 |
猜想 ⑦ ⑦ 不成立 | ||||
| (3) | 用pH试纸测C中混和物pH | pH试纸变为 浅红或是红 浅红或是红 色,pH=3 |
猜想④成立. | ||||
| (4) | 取C中适量混和液,滴加稍过量 碳酸氢钠溶液蒸馏,取馏出物 碳酸氢钠溶液蒸馏,取馏出物 ,再与银氨溶液反应 |
出现银镜 | 猜想③成立,银镜反应离子方程式为 HCHO+2[Ag(NH3)2]++2OH-
HCHO+2[Ag(NH3)2]++2OH-
| ||||
| … | … | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
⑴O、Si、N元素的电负性由大到小的顺序是____________________。C60和金刚石都是碳的同素异形体,二者中熔点较高的是____________。
⑵A为短周期金属元素,依据下表数据,A的基态原子的轨道表示式为
________________________________。
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
⑶过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道的电子排布有关。一般地,若为d0或d10排布时,无颜色;若为d1~d9排布时,有颜色;如[Cu(H2O)4]2+显蓝色。据此判断25号元素Mn形成的络合离子[Mn(H2O)6]2+_____(填“有”或“无”)颜色。
⑷H-C≡C-COOH分子内含有的σ键、π键的个数依次为_______________,其中碳原子的杂化方式为___________________。
⑸CO可以与金属铁形成配合物分子Fe(CO)5。Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键的类型是______________。
⑹W元素的原子的M能层为全充满状态,且核外的未成对电子只有一个,W晶体中微粒的堆积方式是下图中 (选填“甲”、“乙”或“丙”);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为 (写出含a的表达式,用NA表示阿伏加德罗常数)。
甲 乙 丙
查看答案和解析>>
科目:高中化学 来源:2012届湖北省黄冈市高三上学期期末考试理科综合_化学部分(解析版) 题型:填空题
(15分)
原子序数依次递增的X、Y、Z、W是周期表中前30号元素,其中只有X、Y同周期。已知X的最外层电子数是其内层电子数的2倍;X与Y形成的常见化合物之一常被用于高炉炼铁;Z与X同主族,其单质在同周期元素形成的单质中熔点最高;W原子M能层为全充满状态,且核外的未成对电子只有一个。回答下列问题:
(1)从电负性角度分析,X,Y,Z三种元素的非金属活泼性由强到弱的顺序为 。
(2)X、Y分别与H形成的化学键的极性关系为X-H Y-H(填“<”、“>”或“=”)。
(3)+l价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测Z元素的电离能突增应出现在第____电离能。
(4)X的氢化物中X原子的杂化方式为sp2,则相对分子质量最小的分子式为____,
(5)W的价电子排布图为 ;下图____表示的是W晶体中微粒的堆积方式(填甲、乙或丙);若W晶体中一个晶胞的边长为a cm,则W晶体的密度为____(写出含a的表达式,用NA表示阿伏伽德罗常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com