
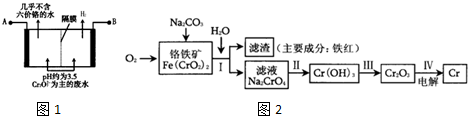
分析 (1)①8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH中,Cr元素的化合价由+6价降低为+3价,生成1mol Cr(OH)3时转移电子1mol×(6-3);
②步骤IV中可用铝于Cr2O3在加热条件下制备Cr;
(2)由图可知,B端生成氢气,则B端氢离子得到电子,所以B为负极,则A为正极;阳极发生Cr2O72-、Fe2+的氧化还原反应,所以阳极几乎不含Cr2O72-;
(3)①酸性条件下,CrO42-和氢离子反应生成Cr2O72-;
②根据反应物、生成物及反应条件书写方程式,并根据得失电子相等配平方程式;
③根据Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-得关系式Cr2O72-----6S2O32-,
根据Cr2O72-和6S2O32-的关系式计算Cr2O72-的物质的量,根据原子守恒计算(NH4)2Cr2O7的质量,再根据质量分数公式计算其质量分数即可.
解答 解:(1)①8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH中,Cr元素的化合价由+6价降低为+3价,则Na2CrO4为氧化剂,该反应中生成1mol Cr(OH)3时转移电子1mol×(6-3)=3mol,故答案为:Na2CrO4;3;
②步骤IV中可用铝于Cr2O3在加热条件下制备Cr,反应的方程式为Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr,故答案为:Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr;
(2)由图可知,B端生成氢气,则B端氢离子得到电子,所以B为负极,则A为正极;阳极发生Cr2O72-、Fe2+的氧化还原反应,所以阳极几乎不含Cr2O72-;,则阳极的氧化还原反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:正极;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(3)①酸性条件下,CrO42-和氢离子反应生成Cr2O72-,离子方程式为:2CrO42-+2H+?Cr2O72-+H2O,故答案为:2CrO42-+2H+?Cr2O72-+H2O;
②在加热条件下,(NH4)2Cr2O7分解生成N2及Cr2O3,同时还生成水,则该反应方程式为:(NH4)2Cr2O7$\frac{\underline{\;\;△\;\;}}{\;}$Cr2O3+N2↑+4H2O,
故答案为:(NH4)2Cr2O7$\frac{\underline{\;\;△\;\;}}{\;}$Cr2O3+N2↑+4H2O;
③根据Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-得关系式Cr2O72-----6S2O32-,
设Cr2O72-的物质的量为x,
Cr2O72-----6S2O32-,
1 6
x 0.1000mol/L×0.03L
1:6=x:(0.1000mol/L×0.03L)
x=0.0005mol,
根据原子守恒得n(Cr2O72-)=n((NH4)2Cr2O7),则m((NH4)2Cr2O7)=0.0005mol×252g/mol=0.126g,
其质量分数=$\frac{0.126g}{0.140g}$×100%=90%,故答案为:90%.
点评 本题以铬为载体考查了实验制备原理,涉及质量分数的计算、氧化还原反应中离子方程式的书写、电解原理等知识点,综合性较强,注意从整体上把握制备流程,明确制备原理,再结合教材基础知识分析解答,题目中信息量较大,同时考查学生信息筛选能力及加工能力,难度较大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量AlO2-的溶液中:Fe3+、Na+、NO3-、Cl- | |
| B. | 使淀粉碘化钾试纸变蓝的溶液中:K+、S2-、Cl-、HCO3- | |
| C. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| D. | 与金属铝反应只能放出氢气的溶液中:NH4+、Cl-、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的工作环境应在高温条件下 | |
| B. | 正极反应:O2+4H++4e-═2H2O | |
| C. | 电池工作时葡萄糖在负极上失去电子发生还原反应 | |
| D. | 电池工作时H+由负极移向正极,但电解液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .已知有机物X的键线式为
.已知有机物X的键线式为 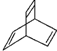 ,Y是X的同分异构体且属于芳香烃.下列关于Y的说法正确的是( )
,Y是X的同分异构体且属于芳香烃.下列关于Y的说法正确的是( )| A. | Y的结构简式为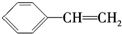 | |
| B. | Y能使溴水褪色,且反应后的混合液静置后不分层 | |
| C. | Y不能发生取代反应 | |
| D. | Y分子中的所有原子一定共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度能减慢反应速率 | |
| B. | 单质碳的颗粒变小能加快反应速率 | |
| C. | 增大H2O蒸气的浓度能加快反应速率 | |
| D. | 加入足量的C能使H2O反应完全 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com