
【题目】已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。
(1)氯化铝是________________(填“离子化合物”或“共价化合物”)。
(2)在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g·L-1,且已知它的结构中有配位键(当共价键中共用的电子对是由其中一原子独自供应,另一原子提供空轨道时,就形成配位键)。配位键形成后,就与一般共价键无异,氯化铝的化学式为________,结构式为________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是______________________。
(4)设计一个更可靠的实验,判别氯化铝是离子化合物还是共价化合物。你设计的实验是________________。
【答案】共价化合物 Al2Cl6 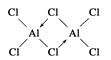 氯化铝为强酸弱碱盐,与空气中的水发生水解反应产生HCl,HCl在空气中形成酸雾而“发烟” 在一定条件下,将AlCl3晶体加热至熔融,然后做导电实验,若不导电,则AlCl3为共价化合物
氯化铝为强酸弱碱盐,与空气中的水发生水解反应产生HCl,HCl在空气中形成酸雾而“发烟” 在一定条件下,将AlCl3晶体加热至熔融,然后做导电实验,若不导电,则AlCl3为共价化合物
【解析】
(1)共价化合物的熔沸点较低,离子化合物熔沸点较高;
(2)根据ρ=M/Vm计算氯化铝蒸气摩尔质量,从而确定其化学式;
(3)氯化铝为强酸弱碱盐,与空气中的水蒸气发生水解反应,生成氯化铝和氯化氢气体,氯化铝是固态小颗粒状,能形成烟,氯化氢气体极易溶于水,在空气中就能形成酸雾,所以氯化铝在空气中形成强烈的“发烟”现象;
(4)熔融状态下离子化合物导电、共价化合物不导电。
(1)由题给数据可知氯化铝的熔沸点较低,不可能是离子化合物,只能是共价化合物,故答案为:共价化合物。
(2)M氯化铝=11.92gL-1×22.4Lmol-1=267 g?mol-1,所以氯化铝的化学式为Al2Cl6,结构式为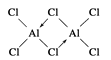 ,
,
故答案为:Al2Cl6; 。
。
(3)氯化铝为强酸弱碱盐,与空气中的水蒸气发生水解反应,生成氯化铝和氯化氢气体,氯化铝是固态小颗粒状,能形成烟,氯化氢气体极易溶于水,在空气中就能形成酸雾,所以氯化铝在空气中形成强烈的“发烟”现象,
故答案为:氯化铝为强酸弱碱盐,与空气中的水发生水解反应产生HCl,HCl在空气中形成酸雾而“发烟”。
(4)离子化合物是由阴阳离子构成的,共价化合物是由分子构成的,共价化合物和离子化合物的典型区别就是熔融状态下离子化合物能导电,而共价化合物不导电,
故答案为:在一定条件下,将AlCl3晶体加热至融化,然后做导电性实验,若不导电,则为共价化合物。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期主族元素,在元素周期表中的相对位置如下图所示,其中Z元素原子之间通常形成Z2分子。下列说法不正确的是( )
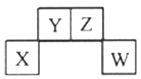
A. X元素的单质既能与强酸反应也能与强碱反应
B. Y元素形成的氢化物在常温下不一定为气体
C. W元素的最高价氧化物对应水化物一定为强酸
D. 由Y、Z、W三种元素形成的二元化合物中只含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 用加热法可除去Na2CO3中的NaHCO3
B. Na2CO3的热稳定性大于NaHCO3
C. 可用石灰水区分Na2CO3与NaHCO3溶液
D. Na2CO3和NaHCO3的水溶液均显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构有关性质和特点,回答下列问题:
(1)Ti基态原子核外电子排布式为 _____基态铝原子核外电子云形状有_________(填名称)。
(2)丙烯腈(CH2=CH-CN)分子中α键和![]() 键的个数比为_____,分子中碳原子轨道的杂化类型是___
键的个数比为_____,分子中碳原子轨道的杂化类型是___
(3)写出与NH4+互为等电子体的一种分子和一种离子的化学式______、_______。
(4)钛存在两种同素异构体,![]() 采纳六方最密堆积,
采纳六方最密堆积,![]() 采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由
采纳体心立方堆积,鉴别两种钛晶体可以用_____法,由![]() 转变为
转变为![]() 晶体体积_____(填“膨胀”或“收缩”)。
晶体体积_____(填“膨胀”或“收缩”)。
(5)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。
(6)Cu与O元素形成的某种化合物的晶胞结构如图所示,晶胞中氧原子的配位数为____,若阿伏伽德罗常数为NA,晶胞的边长为a pm,该晶体的密度为__gcm﹣3.
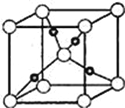
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
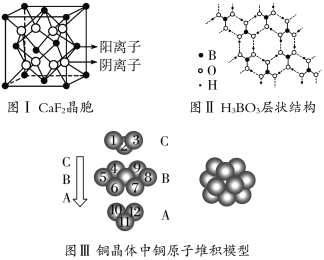
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为________。
(3)三种晶体中熔点最低的是________,其晶体受热熔化时,克服的微粒之间的相互作用为________________________________________________________________。
(4)结合CaF2晶体的晶胞示意图,已知,两个距离最近的Ca2+核间距离为a×10-8 cm,计算CaF2晶体的密度为________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子的核外L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大,请回答下列问题:
(1)XZ2的分子式为__________,分子的立体构型为__________。
(2)YZ2的电子式为__________,其分子中含有__________条![]() 键,__________条π键。
键,__________条π键。
(3)Q的元素符号是__________,属于__________区,它的核外电子排布式为__________。价电子排布图为__________,在形成化合物时它最高的化合价为__________。
(4)E的单质与水反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以干海带为原料提取碘单质和氯化钾的过程主要分三步:完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在____(填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是____。
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液。实验室模拟氧化过程的实验装置如图所示。
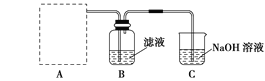
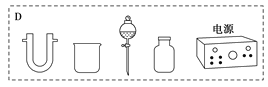
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl-;二是电解法。限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是___(选填编号)。
a.2NaCl(s)+MnO2+2H2SO4(浓)![]() MnSO4+Cl2↑+Na2SO4+2H2O
MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是____。装置C中NaOH的作用是___。
(3)步骤三:取100 mL B中富碘溶液,按如下流程分离碘单质。
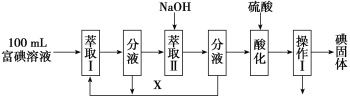
萃取Ⅱ和酸化过程发生的离子反应方程式分别是:
3I2+6OH-=5I-+IO3-+3H2O;____;
萃取剂X应选择____(选填编号)。
a.100mL苯 b.10mL乙醇 c.10 mLCCl4 d.10mL己烯
实验室进行萃取操作的仪器是_____。操作Ⅰ的名称是___。
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:①要用到的化学试剂是___(填写化学式);②要测定的物理量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A(g)+2B(g) ![]() 2C(g) ΔH=-Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
2C(g) ΔH=-Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内气体密度逐渐减小
B. 平衡时,该反应放出的热量为Q kJ
C. 平衡后,再向容器中通入1 mol氦气,A的转化率增大
D. 平衡后,缩小容器容积,A的浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com