
【题目】下列关于有机化合物的说法正确的是( )
A.甲烷和乙烯都可以与氯气反应
B.酸性高锰酸钾可以氧化苯和甲苯
C.乙烯可以与氢气发生加成反应,苯不能与氢气加成
D.溴乙烷在NaOH的醇溶液中充分反应可得到乙醇
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10℃、SO3的沸点为44.8℃。
Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物。

(1)实验前必须进行的操作是_______________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→_________________。
(3)若观察到装置丙中有无色液体产生,装置丁中溶液变成无色,则 FeSO4分解的化学方程式为____________________。
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验1:将稀盐酸和NaOH溶液分别滴入品红水溶液中。观察到前者溶液颜色变浅,但未能完全褪色,后者溶液颜色几乎不变。
实验2:在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2。观察到前者溶液逐渐褪色,后者溶液很快褪色。
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。
(1)由实验1可推测品红水溶液呈________性。
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是_________(填化学式)。
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象________________。
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生产的是 ( )
A. NaHCO3和Al(OH)3 B. BaCl2和NaCl
C. HClO3和K2SO4 D. Na2SO3和BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年世界环境日我国的主题是:改善环境质量,推动绿色发展。符合该主题的措施有( )
A. 燃煤烟气脱硫
B. 大力发展和使用清洁能源
C. 直接排放电镀废水
D. 在汽车尾气系统中装置催化转化器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度/10-3 mol·L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应熵变(ΔS)大于0,焓变(ΔH)大于0,所以在低温下自发进行
C.根据表中数据,计算15.0 ℃时的分解平衡常数约为2.0×10-9
D.达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,只含有下表中所示的四种离子(忽略水的电离),则X离子及其个数b可能为

A.NO3-、4a B.OH-、8a C.SO42-、4a D.SO42-、8a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关C、N、S等非金属元素化合物的说法正确的是( )
A. NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
B. SO2具有漂白性可以使酸性高锰酸钾溶液褪色
C. 实验室可用NaOH溶液处理NO2和SO2废气
D. 稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同)。右侧CO与CO2分子数之比为________________;
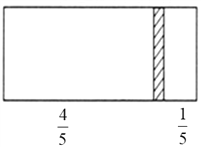
(2)已知质量分数为28%的氨水物质的量浓度为12 mol·L-l,则质量分数为14%的氨水物质的量浓度_____(填“大于”、“小于”或“等于”) 6 mol·L-l;已知4 mol·L-l 的硫酸溶液密度为![]() ,2 mol·L-l 的硫酸溶液密度为
,2 mol·L-l 的硫酸溶液密度为![]() 。100g浓度为4mol·L-l 的硫酸溶液与________mL水混合,使硫酸的物质的量浓度减小到2 mol·L-l 。(用含
。100g浓度为4mol·L-l 的硫酸溶液与________mL水混合,使硫酸的物质的量浓度减小到2 mol·L-l 。(用含![]() 、
、![]() 的式子表示)
的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学反应方程式:(要求写出反应条件)
(1)甲烷与氯气反应生成一氯甲烷 ______________________________________
(2)苯与浓硝酸发生取代反应:________________________________________________
(3)溴乙烷与 NaOH的乙醇溶液加热:_________________________________ (4)乙醇制乙烯:__________________________________
(5)将灼热的铜丝浸入乙醇中: _________________________________ (6)苯酚制三溴苯酚:_____________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com