
下列叙述正确的是
A.Na2O与Na2O2都是碱性氧化物
B.生石灰能与水反应,可用来干燥氨气
C.从海水中提取物质都必须通过化学反应才能实观
D.氯化铝是一种离子型电解质.可用于电解法制铝
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源:2017届四川省资阳市高三上第一次诊断化学试卷(解析版) 题型:填空题
运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)请配平以下化学方程式:
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
若反应过程中转移5 mol电子,则生成标准状况下N2的体积为___________L。
(2)25℃时,将a mol·L-1的氨水与0.1mol·L-1的盐酸等体积混合,当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为_____________。
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式_______________。
(4)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
HSO3-的电离平衡常数表达式K=_________。
0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________。
H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月质检化学试卷(解析版) 题型:选择题
在25 ℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g·cm-3,溶质的质量分数为ω,其中含NH4+的物质的量为b mol,下列叙述中错误的是( )
A.溶质的质量分数为ω=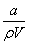 ×100%
×100%
B.溶质的物质的量浓度c=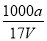 mol·L-1
mol·L-1
C.溶液中c(OH-)=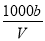 mol·L-1
mol·L-1
D.上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω
查看答案和解析>>
科目:高中化学 来源:2017届山东省栖霞市高三上学期期中化学试卷(解析版) 题型:选择题
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是
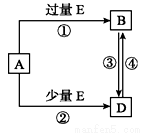
A.若A是铁,则E可能为稀硝酸
B.若A是CuO,E是碳,则B为CO
C.若A是NaOH溶液,E是CO2,则B为NaHCO3
D.若A是A1C13溶液,E可能是稀氨水
查看答案和解析>>
科目:高中化学 来源:2017届山东省栖霞市高三上学期期中化学试卷(解析版) 题型:选择题
下列实验中,无明显现象的是
A.CO2通人CaCl2溶液中 B.NO2通人FeSO4溶液中
C.NH3通入A1C13溶液中 D.SO2通人Ba( NO3)2溶液中
查看答案和解析>>
科目:高中化学 来源:2017届山东省临沂市高三上学期期中化学试卷(解析版) 题型:填空题
综合处理“工业三废”,有利于保护环境,节约资源。
(1)为处理某工厂的工业废气(主要含N2、SO2、NO、CO,不考虑其他成分),设计了如下流程:已知:
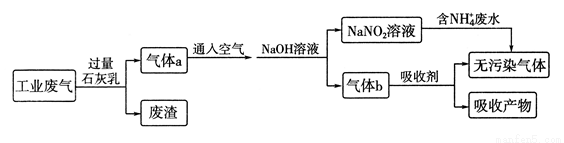
NO+NO2+2NaOH=2NaNO2+H2O;
2NO2+2NaOH=NaNO3+NaNO2+H2O。
①废渣的成分为_____________(填化学式)。
② 通入空气不能过量,原因是______________________。
通入空气不能过量,原因是______________________。
③吸收剂所吸收的气体主要是______________。
④处理含NH4+废水时,发生反应的离子方程式为_____________________。
(2)某无色工业废水中可能含有NH4+、Na+、Al3+、Cu2+、Cl-、SO42-、CO32-等离子中的几种离子。为确定其成分,设计如下实验:
a.取10 mL该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,充分反应后过滤得到0.04 mol白色沉淀,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解。沉淀和气体的物质的量随加入NaOH溶液体积的变化关系如下图所示。(不考虑沉淀、气体的溶解和损失)
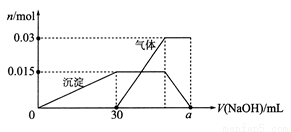
根据上述实验和图表数据:
①该废水中一定含有的离子有_______________(填离子符号)。
②实验室配制100mL所需浓度的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要________________(填仪器名称)。
③图中a=_________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.向次氯酸钙溶液通过量CO2:Ca2++2Cl O-+H2O+CO2=CaCO3↓+2HClO
O-+H2O+CO2=CaCO3↓+2HClO
B.向Ca(HCO3)2溶液中加入过量的NaOH溶液: Ca2++HCO3—+OH—=CaCO3↓+CO32—+H2O
C.酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+=3I2+3H2O
D.氢氧化钡溶液中加入硫酸:Ba2++OH—+H++SO42—= BaSO4+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省海宁市三校高二下学期期中化学试卷(解析版) 题型:填空题
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。

(1)根据如图提供的信息,写出该反应的热化学方程式 ,下图的曲线中 (填“a” 或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达
平衡的是 。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
ⅰ | 450 | 1/3 | 1 |
ⅱ | 1/3 | 10 | |
ⅲ | 480 | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com