
| A. | 葡萄糖和福尔马林与新制氢氧化铜悬浊液共热,都产生砖红色沉淀 | |
| B. | 将乙酸铅、硫酸铵溶液分别加入鸡蛋白溶液中,都产生白色沉淀 | |
| C. | 在苯、已烯中加入溴水振荡静置后,溴水层的颜色均变浅或褪去 | |
| D. | 乙酸钠、苯酚钠、乙醇钠溶液均能使酚酞溶液变红 |
分析 A.葡萄糖是多羟基醛,福尔马林主要成分为甲醛,都含有醛基;
B.将乙酸铅加入鸡蛋白溶液中发生变性析出白色沉淀,鸡蛋白溶液中加入硫酸铵饱和溶液后析出白色沉淀,该过程属于蛋白质的盐析;
C.溴易溶于苯、已烯含有碳碳双键与溴发生加成反应;
D.乙酸钠、苯酚钠、乙醇钠溶液都因水解显碱性.
解答 解:A.葡萄糖是多羟基醛,福尔马林主要成分为甲醛,都含有醛基,与新制氢氧化铜悬浊液共热,都产生氧化亚铜砖红色沉淀,原理相同,故A正确;
B.将乙酸铅加入鸡蛋白溶液中发生变性析出白色沉淀,鸡蛋白溶液中加入硫酸铵饱和溶液后析出白色沉淀,该过程属于蛋白质的盐析,原理不同,故B错误;
C.苯与溴水混合,苯萃取溴分层而使溴水褪色,已烯含有碳碳双键与溴发生加成反应,使溴水褪色,褪色原理不同,故C错误;
D.乙酸钠、苯酚钠、乙醇钠溶液都因水解显碱性,原理相同,故D正确.
故选BC.
点评 本题考查有机物的性质等内容,难度不大,明确原理是解题的关键,加强基础知识的积累掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 金刚石、氮化硼、碳化硅、石英、晶体硅、锗、刚玉均为原子晶体 | |
| B. | 干冰晶体、C60晶体、冰晶体、铜晶体中一个分子或金属原子周围有12个紧邻的分子或金属原子 | |
| C. | 面心立方最密堆积按ABABAB…的方式堆积,配位数为12,空间利用率为74% | |
| D. | 焰色反应的实质是发射光谱 | |
| E. | 第二主族金属元素的碳酸盐受热分解温度会越来越高,原因是晶格能越来越大. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
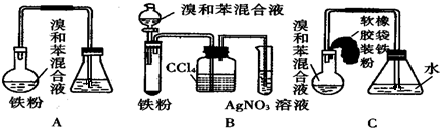
 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$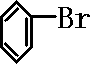 +HBr;装置A中左侧长导管的作用是导气和冷凝回流;装置A和C中的两处明显错误是锥形瓶未与大气相通、导管插入AgNO3(或水)溶液中.
+HBr;装置A中左侧长导管的作用是导气和冷凝回流;装置A和C中的两处明显错误是锥形瓶未与大气相通、导管插入AgNO3(或水)溶液中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与浓硫酸和浓硝酸混合液发生硝化反应 | |
| B. | 与乙醇发生酯化反应 | |
| C. | 在80℃的水中形成乳浊液 | |
| D. | 与福尔马林在沸水浴中便可发生缩聚反应制酚醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制浓硫酸、浓硝酸的混酸时,应将浓硝酸沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 用滴定管、量筒量取5.0mL液体,俯视读数时所得液体体积均大于5mL | |
| C. | 大试管、烧瓶、锥形瓶均可用于组装气体发生装置 | |
| D. | 实验室配制一定质量分数、一定物质的量浓度的溶液时均需使用容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | B. | c(Na+)=c(HCO3-)>c(OH-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) | D. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略溶液体积的变化),
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略溶液体积的变化),查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH)+c(H+ )<c(OH-)+c(CH3COO-) | B. | c(H+ )+c(CH3COOH)=c(OH-)+c(CH3COO-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25°C时,Mg(OH)2固体在20mL0.01 mol•L-1氨水中的Ksp比在20mL0.01mol•L-1NH4Cl溶液中的Ksp小 | |
| D. | 25°C时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com