
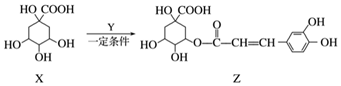
| A. | Z结构中有1个手性碳原子 | |
| B. | Y的分子式为C9H8O4 | |
| C. | 1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH | |
| D. | Z与浓溴水既能发生取代反应又能发生加成反应 |
分析 A.连4个不同基团的C为手性碳原子;
B.由酯化反应及原子守恒可知Y的分子式;
C.Z中-COOH、-COOC-、酚-OH均与NaOH;
D.Z中含酚-OH、碳碳双键.
解答 解:A.连4个不同基团的C为手性碳原子,环己烷结构中与-OH、-COOC-相连的C均为手性碳,共4个,故A错误;
B.由结构简式X为C7H12O6,Z分子式为C16H18O9,由酯化反应规律可知Y的分子式为C9H8O4,故B正确;
C.Z中-COOH、-COOC-、酚-OH均与NaOH,则1mol Z与足量NaOH溶液反应,最多消耗4mol NaOH,故C错误;
D.Z中含酚-OH、碳碳双键,酚-OH的邻对位与溴水发生取代反应,碳碳双键与溴水发生加成,故D正确;
故选AC.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、酯性质的考查,选项B为易错点,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
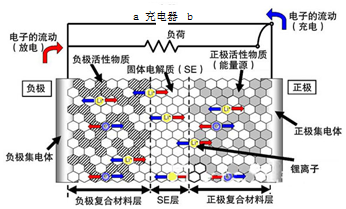 新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )
新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )| A. | 电池放电时,负极发生的反应为:nC+xLi++xe-═LixCn | |
| B. | 充电器的a端接电源的负极,b端接电源的正极 | |
| C. | 电池充电时Li+自左向右移动 | |
| D. | 电池工作时,固体电解质因熔融而导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
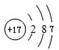 ;D微粒的核外电子排布式为1s2 2s22p6 3s23p6.
;D微粒的核外电子排布式为1s2 2s22p6 3s23p6.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
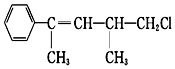
| A. | 在加热和催化剂作用下,最多能与4 mol H2反应 | |
| B. | 能使溴水褪色 | |
| C. | 不能使KMnO4酸性溶液褪色 | |
| D. | 一定条件下,能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
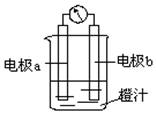 利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )
利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )| A. | a为镁条、b为锌片时,镁条为负极 | |
| B. | a为镁条、b为锌片时,橙汁中阳离子移向b电极 | |
| C. | a为锌片、b为铜片时,铜极上发生还原反应 | |
| D. | a为锌片、b为铜片时,电子由铜片通过导线流向锌片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O3比O2稳定 | |
| B. | O2和O3是氧的两种核素,互称同素异形体 | |
| C. | O2和O3的相互转化是化学变化 | |
| D. | 在标准状况下,等体积的O2和O3含有相同数目的氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
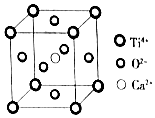
| A. | 该晶体的化学式为CaTiO3 | |
| B. | 该晶体中每个Ti4+和8个O2-相紧邻 | |
| C. | 一个CO2晶胞中平均含有4个CO2分子 | |
| D. | 金属晶体的熔点可能比分子晶体的熔点低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com