

科目:高中化学 来源: 题型:阅读理解

| 操 作 | 现 象 |
| 点燃酒精灯, 加热至170℃ |
Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕, 清洗烧瓶 |
Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |


| 设 计 | 现 象 | |
| 甲 | 在A、B间增加一个装有某种试剂的洗气瓶 | Br2的CCl4溶液褪色 |
乙 |
与A连接的装置如下: |
D中溶液由红棕色变为浅红棕色时,E中溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图装置(夹持装置一起已省略),其实验操作为:先按图安装好,先关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞b和c,而有节奏(间歇性)通入气体,即可在M处观察到明显的实验现象。试回答下列问题:

(1)C中热水的作用:
(2)M处发生的反应的化学方程式为:
(3)从M中可观察到的现象:
从中可认识到该实验过程中催化剂 (填“参加”或“不参加”)化学反应,还可以认识到催化作用需要一定的
(4)实验一段时间后,如果撤掉酒精灯,反应 (填“能”或“不能”)继续进行,其原因是
查看答案和解析>>
科目:高中化学 来源:河北省2011届度高三年级第二次月考化学 题型:填空题
(10分)(1)在定量实验中,采用下列操作会导致实验结果偏低的是 (填序号)。
A.中和热测定实验中以环形铁丝搅拌棒代替环形玻璃搅拌棒
B.配制100mL 2 mol/L的NaCl溶液,以胶头滴管加水定容时,液面稍超出容量瓶刻度线,反复摇匀后,凹液面最低点恰好与刻度线相切
C.测定硫酸铜晶体结晶水含量,加热并搅拌时,有少量固体溅出。
D.称取一定质量无水碳酸钠粉末,用稀盐酸滴定(用甲基橙作指示剂),测定盐酸浓度。酸式滴定管用蒸馏水润洗后未用待装液润洗,立即装液、滴定。
(2)下列实验操作或实验所得出的结论一定正确的是 (填序号)[来源:ZXXK]
A.配制100mL 1.00mol/L的NaCl 溶液时,可用托盘天平准确称取5.85g NaCl
固体
B.某无色溶液中加入盐酸产生无色无味气体且能使澄清石灰水变混浊的气体,则
该溶液中一定含有大量的HCO3-
C.制备Fe(OH)3胶体时,应往沸水中加饱和的FeCl3 溶液,并继续加热到溶液呈
红褐色为止
D.除去蛋白质中混有的少量NaCl,加AgNO3溶液后过滤
E.在中学“硫酸铜晶体里的结晶水含量的测定”实验中,至少需要进行四次称量操
作
F.测定中和热实验中,每次实验均应测量三个温度,即盐酸起始温度,NaOH溶液
的起始温度和反应后溶液的最高温度
(3)根据右图描述回答下列问题:

①关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示。试判断:A装置是否漏气?(填“漏气”、“不漏气”或“不能确定”)
②关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?
(填“漏气”、“不漏气”或“不能确定”) ,判断理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
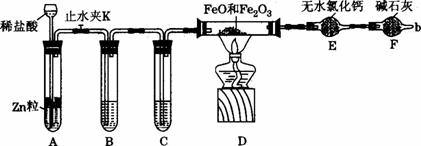
(1)实验前如何检查装置A的气密性:_______________________________________________。
(2)对A中发生的反应,有时要向其中加入少量硫酸铜溶液,目的是:_____________________。
(3)为了实验安全,在点燃酒精灯之前,在F装置出口b处必须___________;实验开始后,在b处必须_______________。
(4)装置B的作用是_____________________,装置C中所盛装的液体是___________________。
(5)干燥管E右边又连接干操管F的目的是____________,若无干燥管F,测得Fe2O3的质量将___________(填“偏大”“偏小”或“无影响”)。
(6)若FeO和Fe2O3混合物的质量为a g,反应完全后干燥管E的质量增加b g,则混合物中Fe2O3的质量分数为_____________(用含字母的数学式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com