
现代工业上用氨与二氧化碳在高压下反应,先生成氨基甲酸铵,再脱水生成尿素。反应式为2NH3+CO2 NH2COONH4;NH2COONH4
NH2COONH4;NH2COONH4 CO(NH2)2+H2O
CO(NH2)2+H2O
根据已学知识推断起固氮作用的化学反应是( )
| A.NO2与H2O的反应生成HNO3和NO | B.NO与O2反应生成NO2 |
| C.NH3经催化氧化生成NO | D.N2 蛋白质 蛋白质 |
科目:高中化学 来源: 题型:计算题
乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下:
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)检验氧化后的溶液中是否仍含有葡萄糖的实验方案为 。
(2)氧化时控制反应液温度为55~60℃的原因是 。
(3)若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为 。
(4)生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
CaCO3是一种化工原料,可以通过反应生成一系列物质,如下图所示。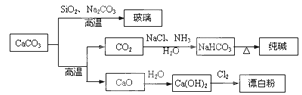
下列说法正确的是
| A.Cl2和SO2均可以漂白有色物质,且漂白的原理相同 |
B.由SiO2+Na2CO3 Na2SiO3+CO2↑可知,H2CO3的酸性强于H2SiO3 Na2SiO3+CO2↑可知,H2CO3的酸性强于H2SiO3 |
| C.工业上,可先向饱和食盐水中通入NH3后,再通入CO2制NaHCO3 |
| D.制取玻璃、纯碱和漂白粉所涉及的反应都是非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学工业有关设备、原料、反应条件配套的是
| A.联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30℃-35℃的氨化饱和食盐水吸收CO2 |
| B.接触法制硫酸:氧化炉、硫铁矿、V2O5、4000-5000 ℃ |
| C.合成氨:沸腾炉、焦炭、铁触媒、5000℃ |
| D.氨氧化法制硝酸:合成塔、空气、铂铑合金、8000℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关工业生产叙述正确的是
| A.工业上通常使用电解法制备金属钠、镁、铝等 |
| B.合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 |
| D.电解精炼铜时,将粗铜与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上常用氟磷灰石[Ca5(PO4)3F]为原料,按如下图所示流程制取磷酸、重过磷酸钙[Ca(H2PO4)2]和氢氟酸。图中反应(Ⅰ)为氟磷灰石跟另一种原料反应,生成A、B、C三种物质,其中的产物C又跟氟磷灰石发生反应(Ⅱ),生成B和重过磷酸钙。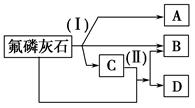
试写出两个反应的化学方程式:反应(Ⅰ)______________;反应(Ⅱ)___ _______
在生产中要特别注意_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2013年度诺贝尔化学奖再次授予计算化学领域的科学家。以下基于结构理论进行繁难计算得出的是
| A.天然气的热值 | B.合成氨的原子利用率 |
| C.尿素的含氮量 | D.p轨道电子云的形状 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为了进一步提高合成氨的生产效率,科研中具有开发价值的是 ( )。
| A.研制高温下活性较大的催化剂 |
| B.寻求NH3的新来源 |
| C.研制低温下活性较大的催化剂 |
| D.研制耐高温高压的新型材料建造合成塔 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列使用化肥、农药的描述中正确的是( )
| A.高温多雨时比较适合施用钾肥 |
| B.长期施用硫铵会造成土壤板结 |
| C.石硫合剂必须与硫酸混合后才能施用 |
| D.草木灰可以和铵态氮肥一块施用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com