
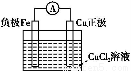
���ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��,����ӡˢ��·�塣ij����ʦΪ�˴ӷ�Һ�л���ͭ,���»��FeCl3��Һ,���������ʵ�鲽��:

д��һ����֤����ԭ��Fe��Cuǿ�����ӷ���ʽ: ��
�÷�Ӧ����ͼ���� �з����������������Ӧ���һ��ԭ���,�ڷ����л�������װ��ͼ(����缫���ơ��缫���ϡ��������Һ)��
|
�������̻��յ�ͭ�Ǵ�ͭ,Ϊ�˻�ø�����ͭ������е�⾫����д����⾫��ʱ�������ϼ���Ҫ�ĵ缫��Ӧʽ ��
Fe+Cu2+=Fe2++Cu ��
��ͭ,Cu-2e-=Cu2+
�����������������Ϣ��֪��ҺӦΪFeCl3��CuCl2��FeCl2�Ļ����Һ,������Լ�aΪFe,������ӦΪ:Fe+2Fe3+=3Fe2+��Fe+Cu2+=Cu+Fe2+,���ٹ��˺�,������Fe��Cu�Ļ����,�ټ��������b(����)������Ӧ:Fe+2HCl=FeCl2+H2��,���ڹ��˺���Һ��Ҫ��FeCl2��Һ,���ϲ������Һ��ͨ��c(Cl2),������Ҫ��ӦΪ:2Fe2++Cl2=2Fe3++2Cl-��Fe+Cu2+=Fe2++Cu����֤��Fe��Cu��ԭ��ǿ,�÷�Ӧ�ڲ�����з�������Fe+Cu2+=Fe2++Cu��Ƴ�ԭ���,Fe������,��Fe�����õ�Cu����������,�������Һ�Ǻ�Cu2+����Һ����⾫��ͭʱ,��ͭ������,��ͭ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ����ר��ͻ�� ר�����ѧ���P���ü�����ϰ���������棩 ���ͣ�ѡ����
�������У���ˮ�ĵ���ƽ�ⲻ����Ӱ����ǣ� ��
A�� B.
B. C��26R3�� D��
C��26R3�� D��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧ����ר��ͻ�� ר��һ���ʵ�������ʺͷ�����ϰ���������棩 ���ͣ������
��1������˵������ȷ����________(����ĸ���)��
A��60��������ı���HQE�����������ȫ���������������������ڼ���������
B�����ȵĴ�����Һϴ��մ�����۵�����ʱ��������Ҫ�ǻ�ѧ�仯
C��Ӣ�������ѧ�Ҹ��������������ά�еĴ���Ӧ���ڹ�ѧͨ�ŷ�����������ͻ���Գɾͣ��������2009��ŵ��������ѧ����������Ʒ�Ļ���ԭ��ΪSiO2
D��Һ����Һ�ȡ�Һ̬�Ȼ��ⶼ�Ƿǵ����
E�������ЧӦ������������Һ�뽺�壬�ơ������ܲ��������ЧӦ
F����ѧ�仯ǰ��ԭ�ӵ����ࡢ��Ŀ���䣬������ĿҲ����
��2�����Ƕ�������ʶ�����м��������ʷ��������һ����dz����ɵͼ���������ʶ���̡�
��1887�갢������˹����������ۡ�
��1923�굤��ѧ�Ҳ���˹�غ�Ӣ����ѧ����������������ۡ������ܹ��ͷ�����(������)���κκ���ԭ�ӵķ��ӻ����Ӷ����������������(������)��ϵķ��ӻ����Ӷ��Ǽ���������ۣ��������ӵ�ˮ��Һ�ȿɿ������ֿɿ��������________(����ĸ���)��
AH2O��BNH4+��COH����DHCO3-��ECH3COO����FCl��
��1923��·��˹(Lewis)����˹��������������ܸ������ӶԶ������γɻ�ѧ���������Ǽ�����ܺ͵��ӶԽ�ϵ����ʶ����ᡣ��
��(���ӶԽ�����)����(���ӶԸ�����)����Ӧ����
H��������������[OH]��������HOH
��ָ������������Ӧ�е����
H3BO3��H2O=H����[B(OH)4]��
�÷�Ӧ�еļ���________(����H3BO3������H2O��)��
CuCl2��4NH3=[Cu(NH3)4]2����2Cl��
�÷�Ӧ�е�����________(����CuCl2������NH3��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��9�������仯������ϰ���������棩 ���ͣ������
��ҵ���þ���þ��(����MgO��KCl��MgCl2��BaCl2��CaCl2��FeCl3������)����MgCl2�Ĺ�ҵ��������:
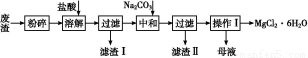
��֪:25 ��ʱ�й����ʵ��ܶȻ�����:
���� | CaCO3 | MgCO3 | BaCO3 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96��10-9 | 6.82��10-6 | 5.1��10-9 | 5.61��10-12 | 2.64��10-38 |
�ش���������:
(1)д���ܽ�ʱ�����ӷ���ʽ ��
(2)�ܽ�ʱ�¶Ȳ���̫��,Ҳ����̫��,Ҫ�������35 ������,�������� ��
(3)����������������,�ֱ�Ϊ ,����,ϴ��,��ɡ����ʱ��Ҫ��ѹ���,ԭ���� ��
(4)Ϊ����Na2CO3����������߲�Ʒ����,���к���(�кͺ���Һ�ӽ�����)����ǰҪ������Һ���Ƿ���� ����,ѡ���������ӵ�ԭ���� ��
(5)ĸҺ����Ҫ�ɷ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��9�������仯������ϰ���������棩 ���ͣ�ѡ����
�����Dz��ֿ�����Դ�����ü���Ʒ����,�й�˵������ȷ����( )
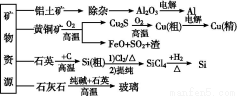
A.��ͭ��⾫��ʱ,��ͭ������
B.��������ͭ���ߴ��輰���������ж��漰������ԭ��Ӧ
C.��ͭ��ұͭʱ,������SO2��������������,FeO������ұ����ԭ��
D.�ֹ��Ƹߴ���ʱ,�ᴿ���Ȼ�����ö�η���ķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��8�绯ѧԭ����ϰ���������棩 ���ͣ�ѡ����
����ͼ����ʾװ��ͨ��10���Ӻ�,ȥ��ֱ����Դ,���ӳ�ͼ����ʾװ��,�ɹ۲쵽U�ι�������缫����������ɫ��״����,U�ι��Ҷ�Һ������������˵����ȷ���ǣ� ��
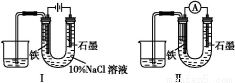
A.ͬ�¡�ͬѹ��,װ�â���ʯī�缫�Ϸ��õ�����������缫�Ϸ��õ��������
B.��װ�â����ʵ��ʱ���缫�ĵ缫��ӦΪFe-2e-+2OH-=Fe(OH)2��
C.��װ�â����ʵ��ʱʯī�缫�ĵ缫��ӦΪ2H++2e-=H2��
D.װ�â�ͨ��10���Ӻ����缫��Χ��ҺpH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��7�������Һ��ϰ���������棩 ���ͣ�ѡ����
���³�ѹ��,��a mol CO2����ͨ��1 L b mol/L��NaOH��Һ��,���ж�������Һ����������ȷ���ǣ� ��
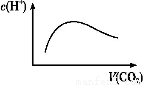
A.��a=2bʱ,����CO2�����ͨ��,��Һ����ˮ�������c(H+)����ͼ�仯��ϵ
B.��a=bʱ,������Һ�д���:c(OH-)+c(C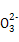 )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)
C.��2a=bʱ,������Һ�д���:c(Na+)��c(C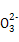 )��c(OH-)��c(HC
)��c(OH-)��c(HC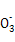 )��c(H+)
)��c(H+)
D.��1/2��a/b��1ʱ,������Һ��һ������:c(Na+)=c(C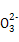 )+c(HC
)+c(HC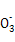 )+c(H2CO3)
)+c(H2CO3)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��6��ѧ��Ӧ���ʺͻ�ѧƽ����ϰ���������棩 ���ͣ�ѡ����
һ���¶���,�ڹ̶��ݻ����ܱ������з������з�Ӧ:2HI H2+I2����HIŨ����0.1 mol��L-1����0.07 mol��L-1ʱ,��Ҫ15 s,��ôHIŨ����0.07 mol��L-1����0.05 mol��L-1ʱ,���跴Ӧ��ʱ��Ϊ�� ��
H2+I2����HIŨ����0.1 mol��L-1����0.07 mol��L-1ʱ,��Ҫ15 s,��ôHIŨ����0.07 mol��L-1����0.05 mol��L-1ʱ,���跴Ӧ��ʱ��Ϊ�� ��
A.����5 s B.����10 s C.����10 s D.��10 s
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ѧר��ͻ��ѵ�� ר��2��ѧ���ü��� ��Һ��ϰ���������棩 ���ͣ�ѡ����
��״����,m1g����A��m2g����B�ķ��������,����˵������ȷ���ǣ� ��
A.1��A���ӵ�������1��B���ӵ������� ��
��
B.ͬ��ͬ�����A��B��������Ϊ
C.ͬ��ͬ������A��B�ķ�������Ϊ
D.ͬ��ͬѹ��A��B���ܶȱ�Ϊ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com