
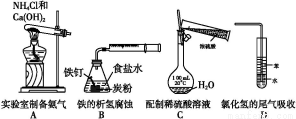
下列操作或仪器的选用正确的是( )
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源:2014高考化学专题突破训练 专题4化学反应中的能量变化练习卷(解析版) 题型:填空题
Ⅰ.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。用乙烯作为还原剂将氮的氧化物还原为N2是燃煤烟气的一种脱硝(除NOx)技术。其脱硝机理如图所示。写出该脱硝过程中乙烯和NO2反应的化学方程式 。
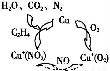
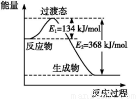
Ⅱ.(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1;
②CH3OH(g)+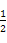 O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1。
O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1。
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1。
则甲醇蒸气完全燃烧生成液态水的热化学方程式为 。
写出甲醇质子交换膜燃料电池在酸性条件下的负极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题1物质的组成性质分类和化学用语练习卷(解析版) 题型:选择题
分类法在化学学科的发展中起到重要作用。下列分类标准合理的是( )
A.根据分散系的稳定性大小将其分为溶液、胶体和浊液
B.根据反应的热效应将化学反应分为放热反应和吸热反应
C.根据溶液导电能力的强弱,将电解质分为强电解质和弱电解质
D.根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题13物质结构与性质选修3练习卷(解析版) 题型:填空题
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。A原子L层的成对电子数和未成对电子数相等,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是 (用对应的元素符号表示);基态D原子的电子排布式为 。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取 杂化;B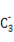 的空间构型为 (用文字描述)。
的空间构型为 (用文字描述)。
(3)1 mol AB-中含有的π键个数为 。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是 。
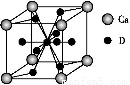
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n= (填数值);氢在合金中的密度为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题12化学实验基本操作与方案设计练习卷(解析版) 题型:实验题
某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列实验方法制备氨气,其中合理的是 (填序号,下同)。
A.将氯化铵固体加热分解
B.将浓氨水滴入氢氧化钠固体中
C.将氢氧化钠固体加入浓氨水中
D.将氯化铵稀溶液滴入氢氧化钠固体中
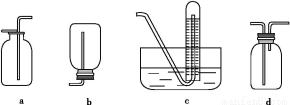
(2)如图是甲同学设计收集氨气的几种装置,其中可行的是 ,集气的原理是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题11常见有机物及其应用练习卷(解析版) 题型:选择题
下列与有机物的结构、性质有关的叙述正确的是( )
A.苯、油脂均不能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.葡萄糖、果糖的分子式均为C6H12O6,两者互为同分异构体
D.乙醇、乙酸均能与Na反应放出H2,两者分子中官能团相同
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题11常见有机物及其应用练习卷(解析版) 题型:选择题
下列说法不正确的是( )
A.氯乙烯、聚乙烯、苯乙烯都是不饱和烃
B.蛋白质溶液中加入浓的硫酸铵溶液会有沉淀析出
C.苯能与溴在一定条件下发生取代反应
D.淀粉和纤维素水解的最终产物都是葡萄糖
查看答案和解析>>
科目:高中化学 来源:2014江苏省扬州市届高三上学期期末考试化学试卷(解析版) 题型:填空题
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)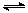 CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)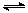 CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)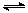 CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g)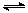 CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有 。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 。
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g) 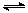 CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%[
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 。
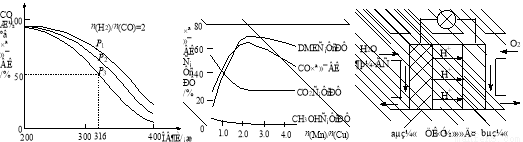
图1 图2 图3
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,
CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习10-1化学实验常用仪器和基本操作练习卷(解析版) 题型:选择题
下列实验操作正确的是( )
①用50 mL量筒量取5.2 mL稀硫酸;②用分液漏斗分离苯和四氯化碳的混合物;③用托盘天平称量117.7 g氯化钠晶体;④用碱式滴定管量取23.10 mL溴水;⑤用瓷坩埚灼烧各种钠的化合物;⑥用250 mL容量瓶配制250 mL 0.2 mol·L-1的NaOH溶液;⑦用浓盐酸清洗做过KMnO4分解实验的试管;⑧将浓硝酸保存在无色试剂瓶中。
A.①②④ B.②③④⑤ C.③⑥⑦ D.②⑤⑥⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com