
| A. | HDO与H2O化学性质不同 | |
| B. | 用漂粉精和洁厕灵(主要成分是盐酸)混合后的浓溶液清洗马桶效果更佳 | |
| C. | 工业上最理想的化学反应是原子利用率达到100%的反应 | |
| D. | 新原子的发现意味着新元素的合成 |
分析 A.HDO与H2O都为水;
B.用漂粉精和洁厕灵(主要成分是盐酸)混合,生成氯气,易中毒;
C.原子利用率达到100%,符合绿色化学的要求;
D.一种元素可存在多种同位素.
解答 解:A.HDO与H2O都为水,化学性质相同,故A错误;
B.漂粉精的主要成分为NaClO,洁厕灵的主要成分为盐酸,二者混合易生成氯气,可导致中毒,不能混合使用,故B错误;
C.反应物的原子全部转化为期望的最终产物,原子的转化率为100%,为最理想的“原子经济”,故C正确;
D.一种元素可能含有几种核素,新核素不一定为新元素,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的组成、性质以及应用,侧重于化学与生活、生产的考查,有利于培养学良好的科学素养,难度不大,注意相关基础知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L甲酸溶液中c(H+)约为1×10-2mol/L | |
| B. | 甲酸能与水以任意比互溶 | |
| C. | 10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应 | |
| D. | 甲酸的导电性比强酸溶液的导电性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
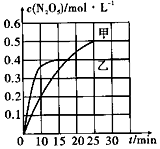 近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.
近日,雾霾又上了度娘热搜榜.其主要成分包括灰尘、SO2、NOx、有机碳氢化合物等粒子.烟气脱硝是治理雾霾的方法之一.| 容器 | 甲 | 乙 |
| 容积/L | 1 | 1 |
| 温度/K | T1 | T2 |
| 起始充入量 | lmolO32mol NO2 | lmolO3 2mol NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与浓硝酸、浓硫酸混合反应制TNT (取代反应) | |
| B. | 苯与乙烯在催化剂存在下反应制取乙苯 (取代反应) | |
| C. | 甲苯与酸性KMnO4溶液反应 (氧化反应) | |
| D. | 甲苯制取甲基环已烷 (加成反应) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质与水反应都能生成碱和H2 | |
| B. | 碱金属单质都是质软、电和热的良导体,焰色反应都呈现黄色 | |
| C. | 碱金属的密度都小于1g/cm3,因此碱金属单质都可以保存在煤油中 | |
| D. | 碱金属单质在空气中燃烧都生成过氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com