
分析 (1)根据中和滴定所需仪器判断;
(2)滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视锥形瓶内溶液颜色的变化;
(3)碘遇淀粉变蓝,若单质碘被还原完,则蓝色褪去;
(4)根据关系式:O2~2MnO(OH)2~2I2~4S2O32-可计算水样中溶解氧的浓度;
(5)根据溶解氧浓度表达式分析不当操作对V(标准)的影响,以此判断浓度的误差;
(6)根据溶解氧浓度表达式分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)中和滴定前需进行赶气泡、调零等操作,用烧杯盛液体,滴定中用锥形瓶盛待测液,用滴定管盛标准液,故所需玻璃仪器有酸式滴定管、碱式滴定管、锥形瓶、烧杯;
故答案为:锥形瓶;烧杯;
(2)滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视锥形瓶内溶液颜色的变化;
故答案为:不断振荡锥形瓶;锥形瓶内溶液颜色的变化;
(3)碘遇淀粉变蓝,若单质碘被还原完,则蓝色褪去,半分钟不恢复蓝色证明达到滴定终点;
故答案为:蓝;无;
(4)根据反应:2Mn2++O2+4OH-═2MnO(OH)2,MnO(OH)2+2I-+4H+═Mn2-+I2+3H2O,I2+2S2O32-═S4O62-+2I-,
可知关系式:O2~2MnO(OH)2~2I2~4S2O32-
32g 4mol
m bmol/L×VmL×10-3L/mL
解得m=8bV×10-3g,则1L水样含氧气质量为:$\frac{8bV×1{0}^{-3}g}{amL×1{0}^{-3}L/mL}$=$\frac{8bV}{a}$g/L;
故答案为:$\frac{8bV}{a}$;
(5)滴定时,滴定管经水洗,蒸馏水洗后加入滴定剂Na2S2O3溶液,标准液体被稀释,浓度变稀,造成V(标准)偏大,根据溶解氧=$\frac{8bV}{a}$g/L,可知浓度偏高;
故答案为:偏高;
(6)记录测定结果时,滴定前仰视刻度线,读数偏大,滴定到达终点时又俯视刻度线,读数偏小,造成V(标准)偏小,根据溶解氧=$\frac{8bV}{a}$g/L,可知浓度偏低,故答案为:偏低.
点评 本题考查了氧化还原滴定的操作、仪器、误差分析和数据处理,难度不大,注意实验的基本操作方法和注意事项.


科目:高中化学 来源: 题型:选择题
| A. | 当5NA个电子转移时,该反应放出650 kJ的热量 | |
| B. | 当1NA个水分子生成且为气体时,放出多于1300 kJ的热量 | |
| C. | 当2 NA个碳氧双键生成时,放出1300 kJ的热量 | |
| D. | 当4NA个碳氧共用电子对生成时,放出1300kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 缩小体积使压强增大 | B. | 体积不变充入稀有气体使压强增大 | ||
| C. | 体积不变充入He使压强增大 | D. | 压强不变充入稀有气体氖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

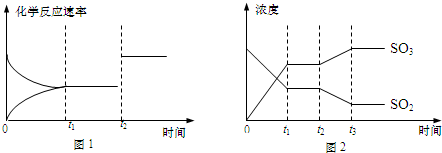
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前度数(mL) | 滴定后度数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
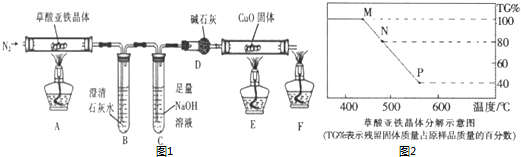
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com