
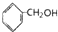
| A. | ①③ | B. | ①④⑤ | C. | ②④ | D. | ①②③⑤ |
分析 能发生酯化反应说明含有-OH或-COOH或二者都有,能发生加成反应说明含有不饱和键或苯环或二者都有,能发生氧化反应说明含有-OH或-CHO或不饱和键或三者都有,以此解答该题.
解答 解:能发生酯化反应说明含有-OH或-COOH或二者都有,能发生加成反应说明含有不饱和键或苯环或二者都有,能发生氧化反应说明含有-OH或-CHO或不饱和键或三者都有,
①CH2=CHCOOH含有羧基和碳碳双键,能发生酯化反应、加成反应和氧化反应,故正确;
②CH2=CHCOOCH3不含羧基或羟基,不能发生酯化反应,故错误;
③CH3CH2CH2OH中不含不饱和键,不能发生加成反应,故错误;
④CH2=CHCH2OH中含有碳碳双键和羟基,能发生氧化反应、加成反应和酯化反应,故正确;
⑤ 中含有苯环,能发生加成反应,含有醇羟基,能发生氧化反应、酯化反应,故正确;
中含有苯环,能发生加成反应,含有醇羟基,能发生氧化反应、酯化反应,故正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,熟悉常见官能团及其性质及常见反应类型,同时考查学生发散思维能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯、乙醇、乙醛 | B. | 乙炔、乙醛、乙二醇 | ||
| C. | 甲醇、甲醚、甲醛 | D. | 乙烷、甘油、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| “嫦娥一号”发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)═2H2O(g)△H=-482.6kJ•mol-1 |
| 北京奥运会“祥云”火炬燃料 | 丙烷(C3H8) | ③C3H8(l)+5O2(g)═3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
| A. | -571.6 kJ•mol-1,-2221.5kJ•mol-1 | |
| B. | -285.8 kJ•mol-1,-2013.8 kJ•mol-1 | |
| C. | -285.8 kJ•mol-1,-2221.5 kJ•mol-1 | |
| D. | -241.3 kJ•mol-1,-2013.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+(2×283.0)kJ/mol | |
| C. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
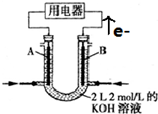
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②③ | C. | ①②③⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
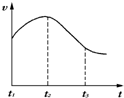 某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
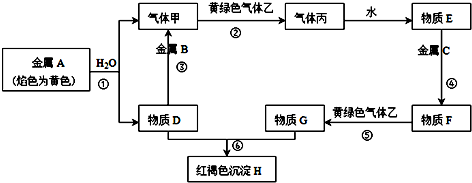
 、D
、D .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中水电离出的c(H+)=10-3mol/L | |
| B. | 溶液中c(A-)=10-3mol/L | |
| C. | 溶液中加水稀释,促进HA电离,溶液的c(H+)增大,但k不变 | |
| D. | 与0.1mol/LNaOH溶液等体积混合后所得溶液中(体积变化忽略不计)c(Na+)═c(A-)+c(OH-)-c(H+)=0.1 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com