
| A. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 | |
| B. | 将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L | |
| C. | 将wg a%的NaCl溶液蒸发掉$\frac{w}{2}$g水,得到2a%的NaCl溶液 | |
| D. | 将1体积c1mol/L的硫酸用4体积水稀释,稀溶液的浓度为0.2c1mol/L |
分析 A、溶液的体积≠溶剂的体积;
B、根据C=$\frac{n}{V}$分析判断,注意体积指溶液体积不是溶剂体积.
C、根据原溶液是否饱和及是否有氯化钠析出分析判断.
D、.根据稀释后溶质物质的量不变来分析;
解答 解:A、5.85gNaCl晶体的物质的量是0.1mol,将5.85gNaCl晶体溶入100mL水中,导致溶液的体积大于100mL,所以配制溶液的物质的量浓度小于0.1mol/L,故A错误.
B、C=$\frac{n}{V}$=$\frac{\frac{25g}{160g/mol}}{0.1L}$=1.56mol/L,故B错误.
C、wga%的NaCl溶液中溶质质量为wa%,蒸发掉$\frac{w}{2}$g水后,溶质不析出,溶质的质量分数=$\frac{wa%}{w-\frac{w}{2}}$=2a%,故C正确;
D、将1体积cmol/L的硫酸溶质物质的量不变,用4体积水稀释,稀释后溶液的体积不是原来的5倍,故稀释后稀溶液的浓度不是0.2cmol/L,故D错误;
故选C.
点评 本题考查了物质的量浓度的有关问题,难度不大,注意公式C=$\frac{n}{V}$中体积指溶液体积不是溶剂体积.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:解答题
 ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个原子轨道里最多只能容纳2个电子,但自旋方向相同 | |
| B. | 任一能层的能级总是从s能级开始,以f能级收尾,而且能级数等于该能层序数 | |
| C. | 同是s能级,在不同的能层中所能容纳的最多电子数是不相同的 | |
| D. | 钠原子核外共有11种运动方式不同的核外电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物的分子式为C10H11O4Cl | |
| B. | 该有机物与浓溴水可发生取代反应,且与浓硫酸混合共热可发生消去反应 | |
| C. | 1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH | |
| D. | 该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于1.12L | B. | 1.12L | ||
| C. | 在1.12L和4.48L之间 | D. | 大于4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成55 g K2S转移电子数为6.02×1023 | |
| B. | S和KNO3均为还原剂 | |
| C. | 反应过程中氮元素被还原 | |
| D. | CO2为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2HI$\frac{\underline{\;高温\;}}{\;}$H2+I2 | ||
| C. | H2O+SO2═H2SO3 | D. | Fe2O2+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
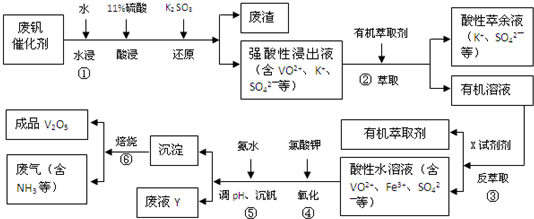
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com