
(16分)
(I)氧化还原反应Cu+2AgNO3=Cu(NO3)2+2Ag可设计成一个原电池,
写出两个电极上的电极反应:负极:____________,正极:_____________。
(II)已知NaHCO3水溶液呈碱性:
(1)用离子方程式表示NaHCO3溶液呈碱性的原因__________________
(2) NaHCO3溶液中各离子的浓度由大到小的关系是________________
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
| 物质 | A | B | C |
| 初始浓度/mol•L—1 | 0.020 | 0.020 | 0 |
| 平衡浓度/mol•L—1 | 0.016 | 0.016 | 0.0080 |
回答下列问题:
(1)反应达到平衡时,A的转化率为_____________。
(2)该反应的化学方程式可表示为(用A、B、C表示物质的化学式)
_____________________________,其平衡常数为_______________。
(3)该温度下,若将A和B各0.10mol的气体混合物充入10L的密闭容器中发生反应,10s末达到平衡,则用A表示的化学反应速率为____________________。
(I)负极:Cu—2e—= Cu2+ 正极:2Ag++2e—=2Ag
(II)(1)HCO3—+ H2O![]() H2CO3 + OH—
H2CO3 + OH—
(2)c(Na+)>c(HCO3—)>c(OH—)>c(H+)>c(CO32—)
(III)(1) 20% (2)A(g)+B(g)![]() 2C(g) 0.25 (3) 0.00020mol•L—1•s—1
2C(g) 0.25 (3) 0.00020mol•L—1•s—1
解析:(1)在原电池中较活泼的金属作负极,失去电子发生氧化反应,正极得到电子,发生还原反应。根据反应可知铜失去电子,Ag+得到电子,所以正负极的电极反应式为2Ag++2e—=2Ag、Cu—2e—= Cu2+。
(2)由于碳酸氢钠在溶液中既有电离平衡,还有水解平衡。电离显酸性,水解显碱性。因为水解程度大于电离程度,所以溶液显碱性。因为在溶液中水还可以电离出氢离子,因此溶液中各离子的浓度由大到小的关系是c(Na+)>c(HCO3—)>c(OH—)>c(H+)>c(CO32—)。
(3)根据数据可知消耗A的浓度是0.020mol/L-0.016mol/L=0.004mol/L,所以A的转化率是![]() ;又因为BC的浓度变化量分别是0.004mol/L、0.008mol/L,所以ABC的浓度变化量之比是1︰1︰2,故方程式为A(g)+B(g)
;又因为BC的浓度变化量分别是0.004mol/L、0.008mol/L,所以ABC的浓度变化量之比是1︰1︰2,故方程式为A(g)+B(g)![]() 2C(g)。平衡常数是平衡时生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数为
2C(g)。平衡常数是平衡时生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数为![]() ;设A的转化量是x,则
;设A的转化量是x,则
A(g)+B(g)![]() 2C(g)
2C(g)
起始量(mol) 0.10 0.10 0
转化量(mol) x x 2x
平衡量(mol) 0.10-x 0.10-x 2x
根据平衡常数的表达式可知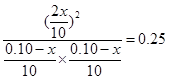
解得x=0.02。所以用A表示的化学反应速率为![]() 。
。


科目:高中化学 来源: 题型:阅读理解
(16分)碘被称为“智力元素”,科学合理地补碘可防止点缺乏症。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如有图所示。
请回答下列问题:
(1)碘是___(填颜色)固体物质,实验室常用____方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2 + 6KOH = 5KI + KIO3+ 3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为________________________;阴极上观察到的实验现象是______________________________。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
| 实验方法 | 实验现象及结论 |
|
|
|
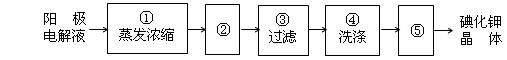
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
步骤②的操作名称______,步骤⑤的操作名称是____________
步骤④洗涤晶体的目的是_______________________________。
查看答案和解析>>
科目:高中化学 来源:2011届广东省中山市高三化学模拟试卷(十) 题型:填空题
(16分)碘被称为“智力元素”,科学合理地补碘可防止点缺乏症。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如有图所示。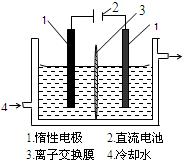
请回答下列问题:
(1)碘是___(填颜色)固体物质,实验室常用____方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2 + 6KOH =" 5KI" + KIO3 + 3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为________________________;阴极上观察到的实验现象是______________________________。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
| 实验方法 | 实验现象及结论 |
| | |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省洪湖市四校高二下学期期中联合考试化学试卷(带解析) 题型:实验题
(16分)
(I)氧化还原反应Cu+2AgNO3=Cu(NO3)2+2Ag可设计成一个原电池,
写出两个电极上的电极反应:负极:____________,正极:_____________。
(II)已知NaHCO3水溶液呈碱性:
(1)用离子方程式表示NaHCO3溶液呈碱性的原因__________________
(2) NaHCO3溶液中各离子的浓度由大到小的关系是________________
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
| 物质 | A | B | C |
| 初始浓度/mol?L—1 | 0.020 | 0.020 | 0 |
| 平衡浓度/mol?L—1 | 0.016 | 0.016 | 0.0080 |
查看答案和解析>>
科目:高中化学 来源:2013届湖北省洪湖市四校高二下学期期中联合考试化学试卷(解析版) 题型:填空题
(16分)
(I)氧化还原反应Cu+2AgNO3=Cu(NO3)2+2Ag可设计成一个原电池,
写出两个电极上的电极反应:负极:____________,正极:_____________。
(II)已知NaHCO3水溶液呈碱性:
(1)用离子方程式表示NaHCO3溶液呈碱性的原因__________________
(2) NaHCO3溶液中各离子的浓度由大到小的关系是________________
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
|
物质 |
A |
B |
C |
|
初始浓度/mol•L—1 |
0.020 |
0.020 |
0 |
|
平衡浓度/mol•L—1 |
0.016 |
0.016 |
0.0080 |
回答下列问题:
(1)反应达到平衡时,A的转化率为_____________。
(2)该反应的化学方程式可表示为(用A、B、C表示物质的化学式)
_____________________________,其平衡常数为_______________。
(3)该温度下,若将A和B各0.10mol的气体混合物充入10L的密闭容器中发生反应,10s末达到平衡,则用A表示的化学反应速率为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com