
 ;A、C元素通过得失电子形成离子化合物MgS,故答案为:
;A、C元素通过得失电子形成离子化合物MgS,故答案为: ;MgS;
;MgS;| 104-32 |
| 4 |


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
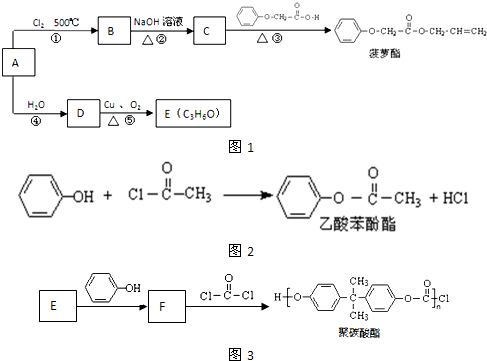
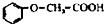 有多种同分异构体,其中属于酯类、能与FeCl3溶液发生显色反应、且苯环上有2种一硝基取代物的同分异构体的结构简式有
有多种同分异构体,其中属于酯类、能与FeCl3溶液发生显色反应、且苯环上有2种一硝基取代物的同分异构体的结构简式有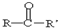 (R、R’代表烷基或H原子)发生缩合反应生成新的有机物和水.
(R、R’代表烷基或H原子)发生缩合反应生成新的有机物和水.查看答案和解析>>
科目:高中化学 来源: 题型:
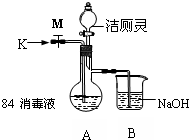
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com