
【题目】A、B、C、D、E五种元素,已知:
①A原子的最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子的最外层上的电子数比最内层多5。
②常温下B2是气体,它的相对分子质量是氢气的16倍。
③C的单质在B2中燃烧,生成淡黄色固体F,F与AB2反应可生成B2。
④D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2,D在DB2中的含量为50%。根据以上情况回答:
(1)E位于第___周期___族;
(2)C的离子结构示意图是_____,F中的化学键为______;
(3)AB2的电子式为___; F和AB2反应的化学方程式为_______;
(4)C、D、E三种元素的原子半径从小到大的顺序为___; (用元素符号回答)
(5)常温下,E的单质与C的最高价氧化物对应水化物的水溶液反应的离子方程式为__________。
【答案】3 ⅦA ![]() 离子键、共价键
离子键、共价键 ![]() 2Na2O2+2CO2=2Na2CO3+O2 Cl<S<Na Cl2+2OH-=Cl-+ClO-+H2O
2Na2O2+2CO2=2Na2CO3+O2 Cl<S<Na Cl2+2OH-=Cl-+ClO-+H2O
【解析】
有题干信息可知:A原子的最外层电子数是次外层电子数的两倍,故A是碳原子,常温下B2是气体,它的相对分子质量是氢气的16倍,故B的相对分子质量为32,结合B的阴离子跟氖原子的电子层结构相同,故B是氧元素,C的单质在B2中燃烧,生成淡黄色固体F,故F为Na2O2,故C为钠元素,C的阳离子Na+跟氖原子的电子层结构相同,Na2O2能与CO2反应可生成O2,进一步说明以上推断是正确的,S的单质在O2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体SO2,S在SO2中的含量为![]() =50%,故D为硫元素,E原子的最外层上的电子数比最内层多5,故E只能是17号元素,故E为氯元素,综上分析可知:A、C;B、O;C、Na;D、S;E、Cl,据此再进行回答下列问题。
=50%,故D为硫元素,E原子的最外层上的电子数比最内层多5,故E只能是17号元素,故E为氯元素,综上分析可知:A、C;B、O;C、Na;D、S;E、Cl,据此再进行回答下列问题。
(1)E是Cl元素,原子结构示意图为: ,根据电子层数等于周期序数,最外层电子数等于其主族序数,故位于第3周期ⅦA族; 故答案为:3;ⅦA;
,根据电子层数等于周期序数,最外层电子数等于其主族序数,故位于第3周期ⅦA族; 故答案为:3;ⅦA;
(2)C是钠元素,其离子结构示意图为![]() ,F是过氧化钠,其中既有离子键又有共价键,故答案为:
,F是过氧化钠,其中既有离子键又有共价键,故答案为:![]() ;离子键和共价键
;离子键和共价键
(3)AB2即CO2的电子式为![]() ; Na2O2和CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:
; Na2O2和CO2反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:![]() ;2Na2O2+2CO2=2Na2CO3+O2;
;2Na2O2+2CO2=2Na2CO3+O2;
(4)C、D、E 三种元素即Na、S、Cl三元素同一周期,原子半径从左往右依次减小,故原子半径从小到大的顺序为Cl<S<Na,故答案为:Cl<S<Na;
(5)常温下,E的单质Cl2与C的最高价氧化物对应水化物即NaOH的水溶液反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 将过量的氨水加入到CuSO4溶液中,最终得到蓝色沉淀
B. 由于氢键的作用,H2O的稳定性强于H2S
C. 在核电荷数为26的元素原子核外价电子排布图为![]()
D. 核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
B.向FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+
C.向澄清石灰水中通入CO2:2OH-+CO2=CO32-+H2O
D.向稀HNO3溶液中加入少量铜粉:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)材料是人类赖以生存的物质基础。
①制造水泥、玻璃都要用到的原料是___(填字母)。
a.石灰石 b.纯碱 c.黏土
②不锈钢丝与棉纤维可织成一种防辐射布料。这种布料属于___(填字母)。
a.合金材料 b.复合材料 c.陶瓷材料
③橡胶可用于制造轮胎,天然橡胶通过___(填字母)措施可增大强度和弹性。
a.硝化 b.氧化 c.硫化
(2)环境保护功在当代、利在千秋。
①燃煤中加入碳酸钙,可减少SO2的排放。表示该反应原理的化学方程式为___。
②治理废水中的重金属污染物可用沉淀法。往含铬(Cr3+)废水中加入石灰乳使Cr3+转变为___(填化学式)沉淀而除去。
③将CO2和H2按物质的量1∶4混合,在Ru/TiO2作催化剂、加热条件下反应可获得CH4。写出该反应的化学方程式:___。
(3)合理选择饮食,有益身体健康。某同学在食堂的午餐是:米饭、红烧肉、西红柿炒鸡蛋和一只苹果。
①其中主要为人体提供能量的食物是___。该食物中的主要成分在人体内完全水解的化学方程式为___。
②西红柿中富含维生素C,西红柿生吃比炒熟后吃维生素C的利用率高,原因是___。用淀粉溶液和碘水检验维生素C的还原性,有关实验操作和现象是___。
③苹果中含有一定量的铁元素,人体缺铁会导致的疾病是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阳离子和一种阴离子且互不重复)。
阳离子 | K+、Na+、Ba2+、NH |
阴离子 | CH3COO-、Cl-、OH-、SO |
已知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离程度相同;D物质的焰色反应呈黄色;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成有刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A的名称是_______B的化学式_______
(2)写出C溶液和D溶液反应的化学方程式___________
(3)25 ℃时,pH=9的A溶液和pH=9的C溶液中水的电离程度小的是___(填A或C)。
(4) A溶液的pH大于7,用离子方程式表示原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某学生为探究AgCl沉淀转化为![]() 沉淀的反应所做实验的记录.
沉淀的反应所做实验的记录.
步骤 | 现象 |
Ⅰ | 立即产生白色沉淀 |
Ⅱ | 沉淀迅速变为黑色 |
Ⅲ | 较长时间后,沉淀变为乳白色 |
Ⅳ | 产生红棕色气体,沉淀部分溶解 |
Ⅴ | 产生白色沉淀 |
![]() 为了证明沉淀变黑是AgCl转化为
为了证明沉淀变黑是AgCl转化为![]() 的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
![]() 已知:
已知:![]() 时
时![]() ,
,![]() ,此沉淀转化反应的平衡常数
,此沉淀转化反应的平衡常数![]() ______。
______。
![]() 步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
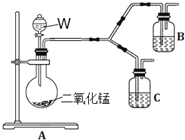
![]() 为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
![]() 装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
![]() 装置C中的试剂为NaCl溶液和
装置C中的试剂为NaCl溶液和![]() 悬浊液的混合物,B中试剂为 ______ 。
悬浊液的混合物,B中试剂为 ______ 。
![]() 实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:______Ag2S+_____NaCl+______ + ______ AgCl+S+ ______
______
C中NaCl的作用是: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的价电子排布式为3d64s2;Z原子的![]() 电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
电子层的p能级上有一个空轨道;Q原子的L电子层的p能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( )
A.元素Y和Q可形成化合物Y2Q3
B.X与![]() 的最高价氧化物对应的水化物,前者的酸性比后者强
的最高价氧化物对应的水化物,前者的酸性比后者强
C.X和Q结合生成的化合物为离子化合物
D.ZQ2是由极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维,该聚酯纤维的结构简式为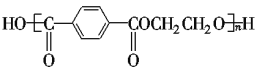 ,下列说法正确的是
,下列说法正确的是
A. 羊毛与该聚酯纤维的化学成分相同
B. 该聚酯纤维和羊毛在一定条件下均不能水解
C. 由单体合成该聚酯纤维的反应属于加聚反应
D. 合成该聚酯纤维的单体为对苯二甲酸和乙二醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下8种化合物中,不能通过化合反应直接生成的有
①Fe3O4 ②Fe(OH)3 ③FeCl2 ④Cu2(OH)2CO3 ⑤Al(OH)3 ⑥Na2CO3 ⑦NaHCO3 ⑧Na2O2
A. 1种 B. 2种 C. 3种 D. 4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com