
【题目】工业合成氨反应具有非常重要的意义。
(1)对可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,若起始投料n(N2)∶n(H2)=1∶1,达到平衡后,降低温度,N2的体积分数_____。
2NH3(g) ΔH<0,若起始投料n(N2)∶n(H2)=1∶1,达到平衡后,降低温度,N2的体积分数_____。
A.增大 B.减小 C.不变 D.不能判断
(2)T ℃,以CO2和NH3为原料可合成化肥尿素:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l);在2 L的密闭容器中,通入1.2 mol NH3和0.6 mol CO2,2 min时反应刚好达到平衡,此时c(NH3)=0.2 mol·L-1,c(CO2)=0.1 mol·L-1。
CO(NH2)2(s)+H2O(l);在2 L的密闭容器中,通入1.2 mol NH3和0.6 mol CO2,2 min时反应刚好达到平衡,此时c(NH3)=0.2 mol·L-1,c(CO2)=0.1 mol·L-1。
①T ℃时该反应的平衡常数K=_____。
②若2 min时保持T ℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6 mol NH3,则此时v正____v逆(填“>”“<”或“=”)。
③若保持T ℃,在2 min时把容器体积瞬间压缩到1 L且保持体积不变,3 min时达到新平衡,请在图中画出2 min到3 min内NH3浓度的变化曲线。_______
(3)NH3催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(l) ΔH,向容积为2 L的恒容密闭容器中,充入NO2和NH3的混合气体0.14 mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图中曲线所示[投料比=n(NO2)/n(NH3)]。
7N2(g)+12H2O(l) ΔH,向容积为2 L的恒容密闭容器中,充入NO2和NH3的混合气体0.14 mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图中曲线所示[投料比=n(NO2)/n(NH3)]。
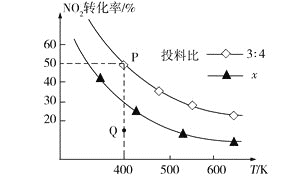
①ΔH____0(填“>”“<”或“=”),理由是_____。
②x_____3∶4(填“>”“<”或“=”),理由是_____。
③400 K时,该反应的平衡常数表达式为____。
④投料比为3∶4时,Q点v逆(NH3)____P点v逆(NH3)(填“>”“<”或“=”)。
【答案】C 250 < 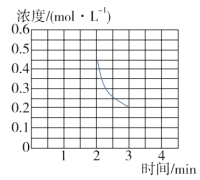 < 升高温度NO2转化率减小平衡逆向移动,所以正反应放热 > 投料比越大NO2的物质的量越大,NO2的转化率越小 c7(N2)/c6(NO2)c8(NH3) <
< 升高温度NO2转化率减小平衡逆向移动,所以正反应放热 > 投料比越大NO2的物质的量越大,NO2的转化率越小 c7(N2)/c6(NO2)c8(NH3) <
【解析】
(1)w(N2)=![]() ×100%=50%,再根据三段式求出反应后氮气的体积分数,前后进行比较;
×100%=50%,再根据三段式求出反应后氮气的体积分数,前后进行比较;
(2)①根据K=![]() 进行计算;
进行计算;
②若保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6mol NH3,体积瞬间变为4L,此时c(NH3)=0.25molL-1,c(CO2)=0.05molL-1,据此分析浓度商与K的关系进行作答;
③2min时把容器体积瞬间压缩到1L,此时c(NH3)=0.4molL-1,保持T℃不变,平衡常数K不变,则3min平衡时NH3浓度仍为 0.2molL-1,据此进行作图;
(3)①升高温度,平衡向吸热方向移动,根据转化率的变化来判断该反应是放热还是吸热,从而分析焓变;
②结合投料比对NO2转化率的影响效果分析;
③依据平衡常数的定义作答;
④投料比为3∶4时P点达平衡,Q点未达平衡,此时NO2的转化率比平衡时小据此分析作答。
(1)开始w(N2)= ![]() ×100%=50%,设开始氮气,氢气的物质的量分别为1mol,1mol,
×100%=50%,设开始氮气,氢气的物质的量分别为1mol,1mol,
N2(g)+3H2(g)2NH3(g)
初始量110
转化量x3x2x
平衡量1x13x2x,
反应后氮气的体积分数为![]() ×100%=
×100%=![]() ×100%=50%,则N2的体积分数恒为50%,由此可见平衡时N2的体积分数保持不变,故答案为:C;
×100%=50%,则N2的体积分数恒为50%,由此可见平衡时N2的体积分数保持不变,故答案为:C;
(1)① 2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l);
初始量(mol/L)0.60.300
转化量(mol/L)0.4 0.2 0.20.2
平衡量(mol/L)0.2 0.1 0.2
K=![]() =
=![]() =250;
=250;
②若保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6molNH3,体积瞬间变为4L,此时c(NH3)=0.25molL1,c(CO2)=0.05molL1,反应的浓度商Q=10.252×0.05=320,Q>K,所以平衡逆向移动,v正<v逆,
故答案为:<;
③2min时把容器体积瞬间压缩到1L,此时c(NH3)=0.4molL1,保持T℃不变,平衡常数K不变,则3min平衡时NH3浓度仍为0.2molL1,故图象为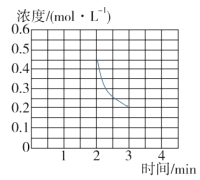 ;
;
(3) ①由图可知,升高温度NO2转化率减小平衡逆向移动,所以正反应放热,则△H<0;
②则从图中可以看出,同一个温度下,x对应的NO2的转化率均小于3:4对应的NO2的转化率,因投料比越大NO2的物质的量越大,NO2的转化率反而越小,故x>3:4;
③6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(l),所以400K时,反应的平衡常数表达式为K= c7(N2)/c6(NO2)c8(NH3);
7N2(g)+12H2O(l),所以400K时,反应的平衡常数表达式为K= c7(N2)/c6(NO2)c8(NH3);
④投料比为3∶4时P点达平衡,Q点未达平衡,此时NO2的转化率比平衡时小,说明此时要继续转化更多的NO2,反应物浓度在减小,生成物浓度在增大,正反应速率在减小,逆反应速率在增大,则可知此时逆反应速率比平衡时逆反应速率小,以氨气表示反应速率得出,Q点v逆(NH3)<P点v逆(NH3)。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农生产中有着重要的应用,请回答下列问题:
(1)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ·mol-1
②1/4CaSO4(s)+CO(g)=1/4CaS(s)+CO2(g) △H=-47.3kJ·mol-1
反应:CaO(s)+3CO(g)+SO2(g)=CaS(s)+3CO2(g) △H=_____________kJ·mol-1
(2)下图为密闭容器中H2S气体分解生产H2和S2(g)的平衡转化率与温度、压强的关系。
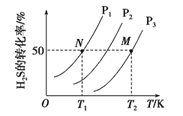
该反应平衡常数的大小关系为K(T1) ____K(T2)(填“>”、“=”或“<”),理由是____。用各物质的平衡分压代替平衡浓度表示反应的平衡常数,记为Kp,计算该反应在T1温度下的Kp=_________(用p1表示)。
(3)在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g) ![]() 2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是________________(用文字表达);10min到15min的曲线变化的原因可能是________(填写编号)。
2SO3 (g)△H<0。据下图判断,反应进行至20min时,曲线发生变化的原因是________________(用文字表达);10min到15min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO2的物质的量
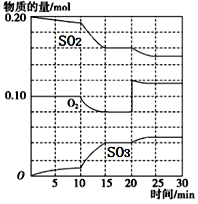
(4)烟气中SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=__________________(用含硫微粒浓度的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,可用如下反应制得:2NaClO3+Na2SO3+H2SO4![]() 2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
A. 该反应属于复分解反应
B. NaClO3被还原,发生还原反应
C. 反应中Na2SO3作氧化剂
D. 生成6.75 g ClO2时,转移0.2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以铝土矿(含 Al2O3、Fe2O3和 SiO2)为原料进行炼铝探究(流程如下),叙述错误的是
![]()
A. 步骤①②过程中均需过滤操作
B. a、b中铝元素的化合价相同
C. 反应③的化学方程式为:2 NaAlO2+3H2O+CO2 = 2Al(OH)3↓+Na2CO3
D. d只能是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去)。

(1)验证碳、硅非金属性的相对强弱(已知酸性:亚硫酸>碳酸)。
①连接仪器、________________、加药品后,打开a、关闭b,然后滴入浓硫酸,加热。②铜与浓硫酸反应的化学方程式是________________,装置A中试剂是_______。③能说明碳的非金属性比硅强的实验现象是_______________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是____________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应的位置______。

写出其中SO2显示还原性生成沉淀的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A与D是常见的有机化工原料,下列路线合成香料M(![]() ):
):

已知以下信息:
①A的相对分子质量为28
②2RCH2CHO![]()

(1)A的结构简式是________,D的名称是__________。
(2)A生成B的反应类型为_____________,G中官能团名称为___________。
(3)E生成F的的化学方程式为_________________________________________。
(4)下列关于G的说法正确的是______________。(填标号)
a.属于芳香烃
b.可与FeCl3溶液反应显紫色
c.1molG与H2完全加成,最多4molH2
d.可与新制的氢氧化铜共热生成红色沉淀
(5)化合物M的同系物N比M的相对分子质量大14,N的同分异构体中同时满足下列条件的共有__________种(不考虑立体构)。
①与化合物M含有相同的官能团; ②苯环上有两个邻位取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
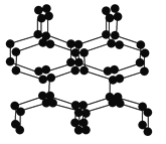
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
A. a=6.00 B. 同时改变反应温度和蔗糖的浓度,v可能不变
C. b<50 D. 50℃时,经过5s蔗糖浓度减少一半
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过石油裂解制得A。以A为原料制取有机玻璃N及隐形眼镜材料M的合成路线如下:

已知: (-R,-R’为可能相同或可能不同的原子或原子团)
(-R,-R’为可能相同或可能不同的原子或原子团)
请回答:
(1)A中官能团的名称是_______,B的结构简式是______。
(2)F→N反应的化学方程式是________,反应类型是________。
(3)C在一定条件下转化为高分子化合物的化学方程式是________。
(4)D有多种同分异构体,符合下列条件的有____种(包括顺反异构体)。
①能发生银镜反应 ②能与NaOH溶液反应
(5)B是一种重要的工业溶剂,请完成A→B的反应的合成路线(有机物写结构简式、无机试剂任选):___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com