
25°C时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.将纯水加热到950C时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加人少量固体碳酸钠,c(H+)减小,Kw不变,促进水的电离
D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,Kw不变
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源:2014高考名师推荐化学物质结构与性质推断(解析版) 题型:填空题
在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Al+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为 ,含有离子键、 等化学键。
(2)生成物中含有10个电子的分子是 (写分子式),该分子的空间构型为 ,中心原子的杂化方式为 。
(3)反应物中电负性最大的元素为 (填元素符号),写出其原子最外层的电子排布图: 。
(4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
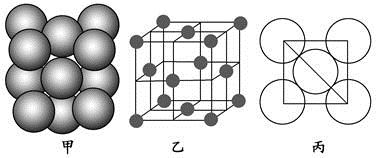
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为 ;Al晶体的密度为 (用字母表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的分离和提纯(解析版) 题型:选择题
关于下列各实验装置图的叙述中,正确的是
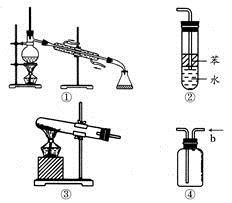
A.装置①可用于分离沸点不同且互溶的液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4Cl为原料,装置③可用于实验室制备少量的NH3
D.装置④中从b口进气可用排水法收集NO2、CO等气体
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化(解析版) 题型:选择题
化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)  CuS(s)+Mn2+(aq),下列说法错误的是
CuS(s)+Mn2+(aq),下列说法错误的是
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数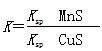
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化(解析版) 题型:选择题
25 ℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法正确的是
A.氯化银、溴化银和碘化银的溶解度依次增大
B.将硫酸银溶解于水后,向其中加入少量硫化钠溶液,不可能得到黑色沉淀
C.在5 mL 1.8×10-5 mol·L-1的NaCl溶液中,加入1滴(1 mL约20滴)0.1 mol·L-1的AgNO3溶液,不能观察到白色沉淀
D.将浅黄色溴化银固体浸泡在饱和氯化钠溶液中,可以有少量白色固体生成
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学水的电离与溶液酸碱性(解析版) 题型:选择题
下列溶液中微粒浓度关系一定正确的是
A 均为0.10mol·L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者小于后者
B 25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW
C 25℃时pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者
D. 25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH< 7
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氯、溴、碘及其化合物主要性质(解析版) 题型:选择题
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是
A.Na2O、Na2O2组成元素相同,推出与水反应产物也完全相同
B.SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强
C.H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO
D.根据常温下铜与浓硝酸可以制取NO2,推出常温下铁与浓硝酸也可以制取NO2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氨及铵盐(解析版) 题型:实验题
为了探究AgNO3的热稳定性,某化学兴趣小组设计了如下实验。用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。
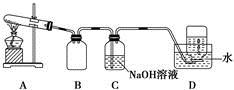
(1)装置B的作用是 。
(2)经小组讨论并验证该无色气体为O2,其验证方法是 。
(3)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量氨水,振荡 | 黑色固体不溶解 |
b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 (填实验编号)。
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧、硫及其化合物主要性质(解析版) 题型:填空题
已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)
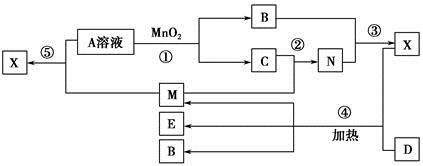
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为________________________
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为___________________________
(4)已知下列几种试剂:
a.无水CuSO4 b.品红溶液 c.酸性KMnO4溶液
d.澄清石灰水 e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebd B.adebC.abcbd D.abd
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com