
| A. | NH4Cl水解呈酸性,不能用来当做肥料使用 | |
| B. | 氧化镁的熔点高,可用于制作耐高温的材料 | |
| C. | 氯碱工业中的“碱”指的是Na2CO3 | |
| D. | 水泥、玻璃等硅酸盐材料指的是以二氧化硅为原料生产的材料 |
分析 A.氯化铵中含有氮元素为铵态氮肥;
B.耐高温的材料应具有熔点高的特点;
C.氯碱工业中的“碱”指氢氧化钠;
D.依据硅酸盐材料的概念解答.
解答 解;A.氯化铵中含有氮元素为铵态氮肥,可以做肥料,但是不能与碱性物质混合使用,故A错误;
B.氧化镁的熔点高,可用于制作耐高温的材料,故B正确;
C.氯碱工业中的“碱”指的是氢氧化钠,电解饱和食盐水生成氯气、氢气和氢氧化钠,故C错误;
D.所谓硅酸盐材料硅酸盐指的是硅、氧与其它化学元素(主要是铝、铁、钙、镁、钾、钠等)结合而成的化合物的总称,故D错误;
故选:B.
点评 本题考查了铵盐、氧化镁的性质,氯碱工业产物、硅酸盐材料定义,侧重考查学生对基础知识的掌握,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
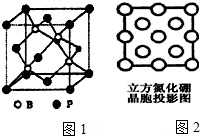 由N、B等元素组成的新型材料有着广泛用途.
由N、B等元素组成的新型材料有着广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
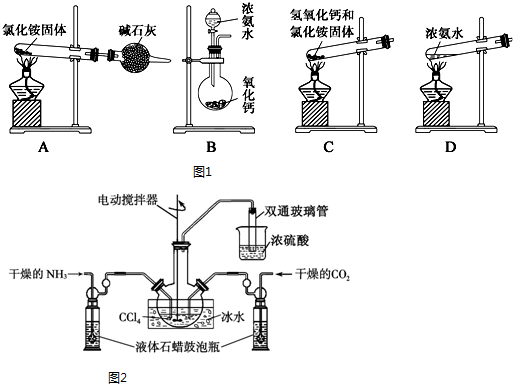
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| B. | 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) | |
| C. | 0.10mol•L-1 KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-) | |
| D. | 0.10mol•L-1Na2SO3溶液通入少量SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质相同 | |
| B. | 凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布 | |
| C. | 一种微粒与另一种微粒的质子数和电子数均相等,它们可能是一种离子和一种分子 | |
| D. | 不存在两种质子数和电子数均相同的阳离子和阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
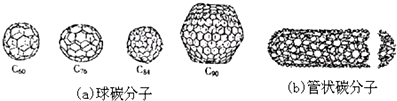
| A. | 金刚石和石墨的熔点肯定要比C60高 | |
| B. | 据估计C60熔点比金刚石和石墨要高 | |
| C. | 无论是球碳分子,还是管状碳分子、洋葱状碳分子,都应看作是碳的同素异形体 | |
| D. | C60的熔点低于C90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com