
| A、①② | B、②③ | C、①③ | D、③④ |


科目:高中化学 来源: 题型:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
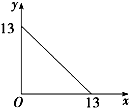 T℃下的溶液中,c(H+)=1.0×10-xmol?L-1,c(OH-)=1.0×10-ymol?L-1,x与y的关系如图所示.下列说法不正确的是( )
T℃下的溶液中,c(H+)=1.0×10-xmol?L-1,c(OH-)=1.0×10-ymol?L-1,x与y的关系如图所示.下列说法不正确的是( )| A、T℃时,水的离子积Kw为1×10-13 |
| B、T>25 |
| C、T℃时,pH=7的溶液显碱性 |
| D、T℃时,pH=12的苛性钠溶液与pH=1的稀硫酸等体积混合,溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(B) |
| c(C) |
| A、③④ | B、①②⑤ |
| C、②③⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、全部 | B、只有①③④ |
| C、只有②④⑤ | D、只有①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol?L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol?L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:
 NO3-+
NO3-+ ═
═ Fe2++
Fe2++ NH4++
NH4++
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com