
甲、乙、丙之间有如下图所示的转化关系,其中甲物质为氧化物:

⑴ 若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液,则甲的一种重要的工业用途是___________________________;
写出下列转化的方程式:
乙 丙的离子方程式_____________________________;
丙的离子方程式_____________________________;
丙 甲的化学方程式______________________________。
甲的化学方程式______________________________。
⑵若甲是不溶于水的黑色固体,且向乙溶液中加入KSCN溶液,混合溶液呈红色,
则甲物质的俗称是_______。
甲 乙的离子方程式是__________________________。
乙的离子方程式是__________________________。
科目:高中化学 来源: 题型:
(1)已知某温度时0.01 mol/L NaOH溶液的pH=10,则此温度下水的离子积常数Kw=1.0×10-12。此温度下将pH=12的NaOH溶液V1 L与pH=1的H2SO4溶液V2 L混合,若所得混合溶液的pH=10,则V1∶V2为 。
(2)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应结束时两溶液的pH均为4。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1 m2(选填“<”、“=”或“>”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO 。关于该物质的说法正确的是( )
。关于该物质的说法正确的是( )
A. 该物质属于两性氢氧化物 B. 该物质是Al(OH)3和Na2CO3的混合物
C. 1 mol NaAl(OH)2CO3最多可消耗3 mol H D. 该药剂不适合于胃溃疡患者服用
D. 该药剂不适合于胃溃疡患者服用
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属及其合金的说法正确的是( )
A. 钠与氧气反应时,反应条件不同产物不同
B. 铝箔在空气中受热可以熔化且会发生剧烈燃烧
C.保险丝的熔点比其成分金属的熔点低,所以电流过大可以熔断
D. 合金中至少含两种金属
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质漂白的叙述中正确的是( )
A.氯水中通入一定量二氧化硫气体可增强氯水的漂白性
B.含有酚酞的氢氧化钠溶液中通入二氧化硫气体,溶液变无色,说明二氧化硫具有漂白性
C.漂白粉是混合物,其有效成分是次氯酸钙,漂白精是纯净物,其成分也是次氯酸钙
D.漂白粉放入稀酸中可以提高漂白速度
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是( )
A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA
D.100ml1mol/LAlCl3溶液中含的阳离子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:
 CO ( g ) + 2H2 ( g )
CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如右图所示,当达到平衡状态A 时,容器的体积为20 L。
CH3OH ( g ) △H =-90.8 kJ·mol-1 在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如右图所示,当达到平衡状态A 时,容器的体积为20 L。
(1)该反应的化学平衡常数表达式为 ▲ 。
(2)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= ▲ L。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是 ▲ (填字母)。
CH3OH(g)在化学平衡状态时的描述正确的是 ▲ (填字母)。
A.CO的含量保持不变 B.容器中CH3OH浓度与CO浓度相等
C.2V正(CH3OH)=V正(H2)D.容器中混合气体的平均相对分子质量保持不变
(4)CO(g)+2H2(g) CH3OH(g),按照相同的物质的量
CH3OH(g),按照相同的物质的量
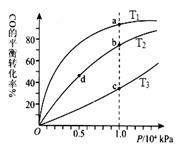 投料,测得CO在不同温度下的平衡转化率与压强的
投料,测得CO在不同温度下的平衡转化率与压强的
关系如右图所示。下列说法正确的是 ▲
A.温度:T1 < T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ; K(b) >K(d)
D.平均摩尔质量:M(a)<M(c); M(b)>M(d)
(5)已知CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1 ,试写出由
CO2和H2制取甲醇的热化学方程式 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述正确的是
A.已知甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g) ====2CO2(g)+2H2O(g) ΔH = - 890.3 kJ·mol-1
B.已知C(石墨,s)====C(金刚石,s) ΔH >0, 则金刚石比石墨稳定
C.已知中和热为ΔH =-57.4 kJ·mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D.已知S(g)+O2(g) ==== SO2(g) ΔH1; S(s)+O2(g) ==== SO2(g) ΔH2, 则ΔH1﹤ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—选修3 物质结构与性质】
(15分)已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
 (2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如右图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com