
������㶨���ܱ������У�һ������SO2��1.100molO2�ڴ��������¼��ȵ�600�淢����Ӧ��2SO2 + O2 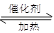 2SO3����H<0������������ʵ�������0.315molʱ��Ӧ�ﵽƽ�⣬����ͬ�¶��²������ѹǿΪ��Ӧǰ��82.5%�������й�������ȷ����
2SO3����H<0������������ʵ�������0.315molʱ��Ӧ�ﵽƽ�⣬����ͬ�¶��²������ѹǿΪ��Ӧǰ��82.5%�������й�������ȷ����
A����SO3������������SO2�������������ʱ��Ӧ�ﵽƽ��
B�������¶ȣ�����Ӧ���ʼ�С�̶ȱ��淴Ӧ���ʼ�С�̶ȴ�
C����ƽ��������ͨ�����BaCl2��Һ�У��õ�����������Ϊ161.980g
D���ﵽƽ��ʱ��SO2��ת����Ϊ90%
��D
����������2SO2
+ O2 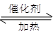 2SO3��
2SO3��
ʼ�� amol 1.100mol 0 mol
���� 2xmol xmol 2xmol
ƽ�� (a-2x) mol (1.100-x) mol 2xmol
������ɵã�a+1.100-(a-2x)- (1.100-x)- 2x=0.315����a+1.100-2x��/��a+1.100��=0.825�����a=0.7��x=0.315��
SO3������������SO2���������ʶ�������Ӧ���ʣ����������ж��Ƿ�ﵽƽ�⣬A����ȷ�������¶ȣ�ƽ��������Ӧ�����ƶ�������Ӧ���ʼ�С�̶ȱ��淴Ӧ���ʼ�С�̶�С��B����ȷ����ƽ��������ͨ�����BaCl2��Һ�У�ֻ��SO3�ᷴӦ�����������ᱵ������Ϊ0.315mol��233g/ mol=73.395 g��C����ȷ���ﵽƽ��ʱ��SO2��ת����Ϊ0.63/0.7=90%��D��ȷ��
���㶨λ�����⿼�黯ѧ��Ӧ���ʺͻ�ѧƽ���й�֪ʶ���漰����ѧ��Ӧƽ����жϡ���ѧ��Ӧ���ʵ�Ӱ�����ؼ���������ʺ���ؼ��㡣


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��2013?����ģ�⣩��֪��Ӧ2CH3OH��g��?CH3OCH3��g��+H2O��g��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£�������㶨���ܱ������м���һ������CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
|
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com