
| A. | 向Fe(NO3)2溶液中加稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 向氯化铵的稀溶液中加入足量NaOH并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | |
| D. | 向稀硝酸中加入铜片:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
分析 A.硝酸根离子在酸性条件下能够氧化亚铁离子,反应生成硝酸铁、一氧化氮和水;
B.加热条件下,铵根离子与氢氧根离子反应生成氨气和水;
C.铵根离子与氢氧根离子反应生成一水合氨,漏掉了铵根离子与氢氧根离子的反应;
D.铜与稀硝酸反应生成硝酸铜、NO气体和水.
解答 解:A.向Fe(NO3)2溶液中加稀硝酸,二者发生氧化还原反应,反应的离子方程式为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,故A正确;
B.向氯化铵的稀溶液中加入足量NaOH并加热,反应生成氨气和水,反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故B正确;
C.向(NH4)2SO4溶液中加入适量Ba(OH)2,反应生成硫酸钡和一水合氨,正确的离子方程式为:2NH4++Ba2++SO42-+2OH-═2NH3•H2O+BaSO4↓,故C错误;
D.稀硝酸中加入铜片,反应生成硝酸铜、NO气体和水,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故D正确;
故选C.
点评 本题考查了离子方程式的正误判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法,如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2CO2=2Na2CO3+O2 | B. | Na2O+CO2=Na2CO3 | ||
| C. | 2NaOH+CO2=Na2CO3+H2O | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1,可知石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液充分混合反应,放出的热量等于57.3 kJ | |
| D. | 2g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H++2e-═H2↑ | B. | Fe-2e-═Fe2+ | ||
| C. | 2H2O+O2+4e-═4OH- | D. | Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子的最外层电子数依次减少 | |
| B. | N、O、F元素的最高正价依次升高 | |
| C. | C、N、O的原子半径依次减小 | |
| D. | Li、Na、K的金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
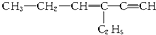 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面上的碳原子数为c,则a、b、c分别为( )| A. | 4,3,5 | B. | 4,3,6 | C. | 2,5,4 | D. | 4,6,4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 | |
| 密度/(g/cm3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 118.0 | 118.1 | 126.1 | 142 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com