
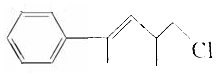
 的下列叙述中不正确的是( )
的下列叙述中不正确的是( )| A. | 分子式是C12H15Cl,属于卤代烃 | |
| B. | 1mol该物质最多能与4molH2发生加成反应 | |
| C. | 既能使溴水褪色,又能使KMnO4 酸性溶液褪色 | |
| D. | 该溶液与酸化的AgNO3 溶液混合时会产生白色沉淀 |
科目:高中化学 来源: 题型:解答题
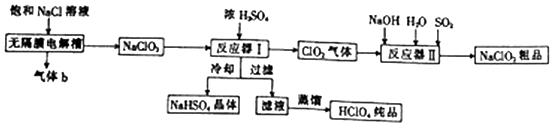
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀盐酸中加入少量金属钠:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 向氯化铁溶液中滴加碳酸氢钠溶液:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑ | |
| C. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O | |
| D. | 将过量的SO2通入漂白粉溶液中:Ca2++2ClO-+2SO2+2H2O═CaSO4↓+2Cl-+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 泥水 | B. | 蒸馏水 | C. | 硫酸铜溶液 | D. | 氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是乙烯 | B. | X能使溴水褪色 | ||
| C. | X属于不饱和烃 | D. | X的二氯代物有三种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有Cu2+ | B. | Fe2+、Cu2+ | C. | Fe3+、Fe2+ | D. | Fe3+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| B. | H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 将Na投入到CuSO4溶液中:2Na+Cu2+═2Na++Cu↓ | |
| D. | 将Cl2通入水中:Cl2+H2O═2H-+Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

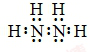 ;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-
;N2H4在水中的第一步电离方程式为N2H4+H2O?N2H5++OH-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com