ŅŌĻĀŹĒ¶Ō»Æѧ·“Ó¦±ä»Æ¹ż³Ģ¼°½į¹ūµÄŃŠ¾æ£®°“ŅŖĒó»Ų“šĪŹĢā£ŗ
£Ø1£©¹ŲÓŚÄÜĮæ±ä»ÆµÄŃŠ¾æŅŃÖŖ£ŗ
¢Ł2CH
3OH£Ø1£©+3CO
2£Øg£©=2CO
2£Øg£©+4H
2O£Øg£©”÷H=-akjmol
-¢ŚCH
3OH£Ø1£©+O
2£Øg£©=CO£Øg£©+2H
2O£Ø1£©”÷-bkjmol
- ¢ŪH
2O£Øg£©=H
2O£Ø1£©”÷H=-ckjmol
-Ōņ£ŗ2CO£Øg£©+O
2£Øg£©=2CO
2£Øg£©”÷H=
kJ?mol
-1£®
£Ø2£©¹ŲÓŚ·“Ó¦ĖŁĀŹŗĶĻŽ¶ČµÄŃŠ¾æ
¢ŁŅŃÖŖ25”ꏱӊ¹ŲČõĖįµÄµēĄėĘ½ŗā³£Źż£ŗ
| ČõĖį»ÆѧŹ½ |
CH3COOH |
HCN |
H2CO |
| µēĄėĘ½ŗā³£Źż£Ø25”ę£© |
1.8”Į10-5 |
4.9”Į10-10 |
K1=4.3”Į10-7 K1=5.6”Į10-11 |
ŌņµČĪļÖŹµÄĮæÅØ¶ČµÄ£Øl£©CH
3COONa”¢¢ŚNaCN”¢¢ŪNa
2CO
3”¢¢ÜNaHCO
3ČÜŅŗµÄpHÓɓ󵽊”µÄĖ³ŠņĪŖ
£ØĢī±ąŗÅ£©
¢ŚŅŃÖŖ2SO
2£Øg£©+O
2£Øg£©?2SO
3£Øg£©£ŗ”÷H=-196kjmol£¬ŌŚŅ»øöČŻ»żĪŖ2LµÄČŻĘ÷ÖŠ¼ÓČė2molSO
2ŗĶlmol O
2£¬ŌŚÄ³ĪĀ¶ČĻĀ³ä·Ö·“Ó¦£¬¾¹ż30min“ļµ½Ę½ŗā£¬·Å³öČČĮæ176.94kJ£®Čē¹ūÓĆSO
2±ķŹ¾øĆ·“Ó¦µÄ·“Ó¦ĖŁĀŹ£¬Ōņv£ØSO
2£©=
£®
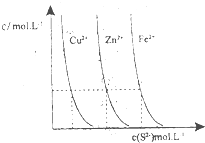
¢ŪĶ¼ĪŖijĪĀ¶ČĻĀ£¬CuS£Øs£©”¢ZnS£Øs£©”¢FeS£Øs£©·Ö±šŌŚČÜŅŗÖŠ“ļµ½³ĮµķČܽāĘ½ŗāŗó£¬ČÜŅŗµÄS
2-ÅØ¶Č”¢½šŹōŃōĄė×ÓÅØ¶Č±ä»ÆĒéæö£®Čē¹ūĻņČżÖÖ³ĮµķÖŠ¼ÓŃĪĖį£¬×īĻČČܽāµÄŹĒ
£®ĻņŠĀÉś³ÉµÄZnS×ĒŅŗÖŠµĪČė×ćĮæŗ¬ĻąĶ¬ÅØ¶ČµÄCu
2+ӢFe
2+µÄČÜŅŗ£¬Õńµ“ŗó£¬ZnS³Įµķ»į×Ŗ»ÆĪŖ
£ØĢī»ÆѧŹ½£©³Įµķ£®
£Ø3£©¹ŲÓŚµē»ÆѧµÄŃŠ¾æČ«·°ŅŗĮ÷µē³ŲŹĒŅ»ÖÖŠĀŠĶµÄĀĢÉ«»·±£“¢Äܵē³Ų£®Ęäµē³Ų×Ü·“Ó¦ĪŖ£ŗ
VO2++2H++V2+ V
3+VO
2++H
2O£®Ōņ³äµēŹ±Ńō¼«·“Ó¦Ź½ĪŖ
£¬ÓĆ“Ėµē³Ųµē½ā1L 1mol?L
-1µÄCuSO
4ČÜŅŗ£¬µ±×ŖŅĘ0.1molµē×ÓŹ±£¬ČÜŅŗµÄpH=
£Ø²»æ¼ĀĒČÜŅŗĢå»ż±ä»Æ£©£®




 ŅŌĻĀŹĒ¶Ō»Æѧ·“Ó¦±ä»Æ¹ż³Ģ¼°½į¹ūµÄŃŠ¾æ£®°“ŅŖĒó»Ų“šĪŹĢā£ŗ
ŅŌĻĀŹĒ¶Ō»Æѧ·“Ó¦±ä»Æ¹ż³Ģ¼°½į¹ūµÄŃŠ¾æ£®°“ŅŖĒó»Ų“šĪŹĢā£ŗ