
下列说法中正确的是
| A.所有主族元素的正化合价数,等于它的族序数 |
| B.第ⅦA族元素的原子随核电荷数的增加,得电子能力逐渐减弱 |
| C.第ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 |
| D.前三周期元素中共有非金属元素12种 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
X、Y为短周期元素,X位于ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是
| A.X的原子半径一定大于Y的原子半径 |
| B.X与Y的简单离子不可能具有相同的电子层结构 |
| C.两元素形成的化合物中,原子个数比不可能为1∶1 |
| D.X2Y可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
具有下列电子层结构的原子,其相应元素一定属于同一主族的是
| A.3p轨道上有2个未成对电子的原子和4p轨道上有2个未成对电子的原子 |
| B.3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子 |
| C.最外层电子排布为1s2的原子和最外层电子排布为2s22p6的原子 |
| D.最外层电子排布为1s2的原子和最外层电子排布为2s2的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
应用元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质。下列预测中不正确的是
①Be的氧化物的水化物可能具有两性
②Tl能与盐酸和NaOH溶液作用,均产生氢气
③At单质为有色固体,At难溶于水易溶于四氯化碳
④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱
⑤SrSO4是难溶于水的白色固体
⑥H2Se是无色、有毒,比H2S稳定的气体
| A.①②③④ | B.②④⑥ | C.①③⑤ | D.②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列结论错误的是
①粒子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
| A.只有① | B.①③ | C.②④⑤⑥⑦ | D.①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图是元素周期表短周期元素的一部分。已知M最高价氧化物对应的水化物为常见的氧化性酸,下列说法正确的是: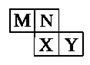
| A.M为氮元素 |
| B.原子半径:Y>X |
| C.氢化物沸点:X>N |
| D.M、X、Y三种元素的最高价氧化物对应的水化物均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是
| A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
| B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
| C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
| D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com