
| A. | 无色溶液中可能大量存在Cu2+、K+、Cl?、NO3- | |
| B. | 酸性溶液中可能大量存在Na+、HCO3-、SO42?、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 中性溶液中可能大量存在Na+、K+、Cl?、SO42? |
分析 A.铜离子为有色离子,不满足溶液无色的条件;
B.碳酸氢根离子与酸性溶液中的氢离子反应;
C.碳酸氢根离子与碱性溶液中的氢氧根离子反应;
D.四种离子之间不反应,且都不发生水解.
解答 解:A.Cu2+为有色离子,在溶液中不能大量存在,故A错误;
B.酸性溶液中存在大量氢离子,HCO3-与氢离子反应,在溶液中不能大量共存,故B错误;
C.碱性溶液中存在大量氢氧根离子,HCO3-与氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.Na+、K+、Cl?、SO42?之间不反应,且为中性溶液,在溶液中能够大量共存,故D正确;
故选D'.
点评 本题考查离子共存,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0 | 28 | 35.7 | 4.7 | 163 |
| 40 | 40.1 | 36.4 | 26.3 | 215 | |
| 80 | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH 溶液和CO2 的反应 | B. | Ba(OH)2 溶液和稀H2SO4 的反应 | ||
| C. | NaHSO4溶液和KOH 反应 | D. | 石灰乳和稀H2SO4 的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
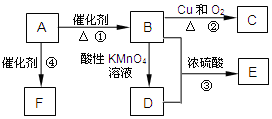 有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.
有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将少量的氯水滴入到适量NaBr溶液中,再滴入少量的CCl4溶液并用力振荡 | A.溶液分为上下两层,上层为无色,下层为橙红色 |
| ②将少量的溴水滴入到适量KI溶液中,再滴入少量的CCl4溶液并用力振荡 | B.溶液分为上下两层,上层为无色,下层为紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 2 min末浓度/mol•L-1 | 0.08 | a | b |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X 的转化率为20% | |
| B. | t℃时,该反应的平衡常数为40 | |
| C. | 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 | |
| D. | 前2 min 内,用Y 的变化量表示的平均反应速率v(Y)=0.03 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com