
分析 (1)据溶液配置需用的仪器分析;
(2)9.32g为不溶于盐酸的硫酸钡沉淀进行分析;
(3)据NH+4+OH-=NH3↑+H2O分析为氨气;得到的固体是氧化铁;
(4)②9.32g为不溶于盐酸的硫酸钡沉淀,③标准状况下气体224mL气体为氨气,红褐色沉淀为氢氧化铁,④得到的固体是氧化铁,根据以上分析数据及电荷守恒,计算出黄钾铵铁矾各种成分的物质的量之比,就是黄钾铵铁矾的化学式.
解答 解:(1)移液时用到的玻璃仪器有容量瓶,烧杯,玻璃棒,故答案为:烧杯,玻璃棒;
(2)9.32g为不溶于盐酸的硫酸钡沉淀,硫酸钡的物质的量就等于溶液中硫酸根的物质的量:n(SO42-)=n(BaSO4)=$\frac{9.32g}{233g/mol}$=0.04 mol,
故答案为:SO42-;0.04mol
(3)NH+4+OH-=NH3↑+H2O,故为氨气;得到的固体是氧化铁,
故答案为:NH3;氧化铁;
(4)所得气体为氨气,溶液中铵离子物质的量就等于氨气的物质的量:n(NH4+)=n(NH3)=$\frac{0.224L}{22.4L/mol}$=0.01 mol
最终得到的固体是氧化铁,根据铁原子守恒,溶液中的铁离子物质的量为:n(Fe3+)=2n(Fe2O3)=2×$\frac{4.8g}{160g/mol}$=0.06 mol
黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]中,n(K+)=n(NH4+)=0.01 mol,
根据电荷守恒:n(OH-)=n(K+)+n(NH4+)+3n(Fe3+)-2n(SO42-)=0.12 mol
n(K+):n(NH4+):n(Fe3+):n(SO42-):n(OH-)=1:1:6:4:12
黄钾铵铁矾的化学式为KNH4Fe6(SO4)4(OH)12,
故答案为:KNH4Fe6(SO4)4(OH)12.
点评 本题考查了制取黄钾铵铁矾,涉及的内容不多,但是计算量稍大,注意合理分析、理解题中信息及电荷守恒的应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
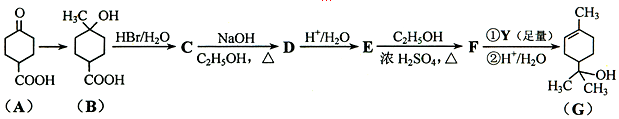
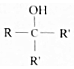
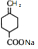 .
.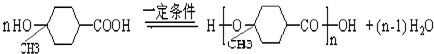 ;写出同时满足下列条件的B的链状同分异构体的结构简式
;写出同时满足下列条件的B的链状同分异构体的结构简式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都涉及有氧化还原反应 | |
| C. | 漂白粉、冰醋酸、氢氧化铁胶体均为混合物 | |
| D. | 二氧化氮、二氧化硅都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
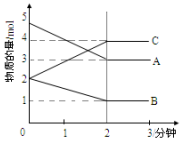 在一定温度压强下,某反应在某体积为5L的密闭容器中进行,各物质的量的变化情况如图所示(A,B,C均为气体)
在一定温度压强下,某反应在某体积为5L的密闭容器中进行,各物质的量的变化情况如图所示(A,B,C均为气体)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(酸)=10V(碱) | B. | V(碱)=10V(酸) | C. | V(酸)=9V(碱) | D. | V(碱)=9V(酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池负极的电极反应为:Al-3e═Al3+ | |
| B. | 电池工作时,溶液中的铝离子向正极移动 | |
| C. | 消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 | |
| D. | 正极的电极材料是单质碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1L某混合溶液中可能含有的离子如表:
1L某混合溶液中可能含有的离子如表:| 可能大量含有的阳离子 | H+NH4+Al3+K+ Mg2+ |
| 可能大量含有的阴离子 | Cl-Br-I?AlO2- CO32- |
| Cl2的体积(标准状况) | 11.2L | 22.4L | 28L |
| n(Cl-) | 2.5mol | 3.5mol | 4.0mol |
| n(Br-) | 3.0mol | 2.5mol | 2.0mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘单质的升华过程中不存在化学键破坏的过程 | |
| B. | NaCl溶于水后,因为共价键被破坏,从而形成了Na+和Cl- | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | H2S分子中,所有原子的最外层都达到了8电子的稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com