
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
分析 ①非金属性越强,气态氢化物越稳定;
②同周期从左到右原子半径依次减小,同主族自上而下原子半径逐渐增大;
③原子晶体的熔点大于分子晶体;
④根据H2O、CH3COOH、HCl的电离程度越大,其离子结合质子能力越弱.
解答 解:①非金属性F>O>S,气态氢化物稳定性强弱:HF>H2O>H2S,故①错误;
②同周期从左到右原子半径依次减小,同主族自上而下原子半径逐渐增大,因此原子半径Na>Mg>S>O,故②正确;
③SiO2为原子晶体,熔点最高,故③错误;
④因H2O、CH3COOH、HCl的电离程度:HCl>CH3COOH>H2O,所以结合质子能力OH->CH3COO->Cl-,故④正确;
故选B.
点评 本题考查元素周期律的递变规律,侧重于学生的分析能力和基本概念的综合理解和运用的考查,注意把握元素与对应单质、化合物的性质的相似性和递变性的判断,注重基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na3PO4 | B. | Na3PO3 | ||
| C. | Na4P2O7 和Na5P3O10 | D. | Na3PO4、Na4P2O7和Na5P3O10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24Cr的电子排布式:1s22s22p63s23p63d54s1 | |
| B. | K的简化电子排布式:[Ar]4s1 | |
| C. | N原子的电子排布图: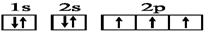 | |
| D. | S原子的电子排布图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| C. | 要除去乙烷中混有的乙烯气体可将混合气体通过盛有酸性高猛酸钾溶液的洗气瓶 | |
| D. | 用分液漏斗可以分离溴和CCl4、苯和水、乙酸和乙醇等液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物的结构简式如图,取足量的H2、NaOH溶液和溴水分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的H2、NaOH和Br2三种物质的物质的量之比是( )
某有机物的结构简式如图,取足量的H2、NaOH溶液和溴水分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的H2、NaOH和Br2三种物质的物质的量之比是( )| A. | 3:4:1 | B. | 5:4:1 | C. | 3:5:1 | D. | 3:5:0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,系统命名的名称为2,3-二甲基-2-丁烯.
,系统命名的名称为2,3-二甲基-2-丁烯.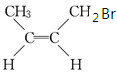 反式
反式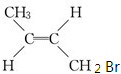 若用丙烯制取1,2,3-三溴丙烷,最适合的方法是先溴单质与丙烯在高温下发生α-H取代反应生成生成3-溴丙烯再让3-溴丙烯和溴单质加成,此时才能得到1,2,3-三溴丙烷.
若用丙烯制取1,2,3-三溴丙烷,最适合的方法是先溴单质与丙烯在高温下发生α-H取代反应生成生成3-溴丙烯再让3-溴丙烯和溴单质加成,此时才能得到1,2,3-三溴丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
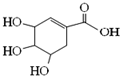
| A. | 分子式为C7H6O5 | |
| B. | 分子中的碳原子都在同一平面 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出氢离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com