
| A. | 为了增强其氧化性,在配制时加入一定浓度的盐酸 | |
| B. | 该物质在反应中可以被还原,也可以被氧化 | |
| C. | 可用酸化的KMnO4溶液除去甲烷中的乙烯 | |
| D. | KMnO4中Mn元素为其最高价+7,故含有最高价元素的化合物,均有强氧化性,如浓硫酸、浓硝酸 |
分析 A.浓盐酸具有还原性,能被锰酸钾溶液氧化生成氯气;
B.该物质中Mn元素处于最高价,能被还原,O元素处于最低价,能被氧化;
C.乙烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,甲烷和酸性高锰酸钾溶液不反应;
D.含有最高价元素的化合物不一定有强氧化性.
解答 解:A.浓盐酸能被高锰酸钾溶液氧化而使高锰酸钾氧化性减弱,为了增强其氧化性,在配制时加入一定浓度的硫酸,故A错误;
B.高锰酸钾发生分解反应得到锰酸钾、二氧化锰和氧气,高锰酸钾在反应中既发生还原反应,又发生氧化反应,故B正确;
C.乙烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,但是甲烷中引入了二氧化碳杂质,甲烷和酸性高锰酸钾溶液不反应,可以用酸化的KMnO4溶液鉴别甲烷和乙烯,故C错误;
D.含有最高价元素的化合物不一定有强氧化性,如浓磷酸,故D错误;
故选:B.
点评 本题考查氧化还原反应,为高频考点,侧重考查学生分析判断能力,明确氧化还原反应特点是解本题关键,知道物质性质与化合价的关系,注意酸性高锰酸钾溶液能鉴别甲烷和乙烯,但不能除去甲烷中的乙烯,题目难度不大.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+ 1s22s22p6 | B. | F?1s22s22p6 | C. | N3+ 1s22s22p6 | D. | O 1s22s22p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | cbadef | B. | dacfbe | C. | badcfe | D. | cbadfe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓盐酸}$Cl2$\stackrel{石灰水}{→}$漂白粉 | |
| C. | 黄铁矿$→_{煅烧}^{沸腾炉}$SO2$→_{O_{2}}^{接触室}$SO3$→_{水}^{吸收塔}$稀硫酸 | |
| D. | 铝土矿$→_{过滤}^{NaOH溶液}$NaAlO2溶液$→_{过滤}^{CO_{2}}$Al(OH)3$\stackrel{△}{→}$Al2O3$\stackrel{电解}{→}$Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L | B. | 0.25 mol/L | C. | 0.1 mol/L | D. | 1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯都能使溴水褪色,褪色的原理相同 | |
| B. | 由甲苯硝化制三硝基甲苯(TNT)和由甲苯氧化制苯甲酸属于同一种反应类型 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 除去C2H2中的杂质H2S,可依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
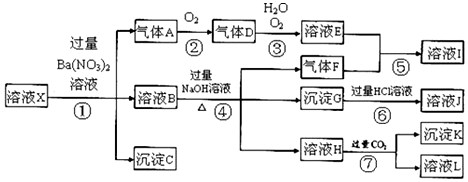
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com