
 2NH3(g)△H=-92kJ?mol-1
2NH3(g)△H=-92kJ?mol-1 2NH3(g)△H=-92kJ?mol-1
2NH3(g)△H=-92kJ?mol-1 Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq) Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq) H++HCO3-
H++HCO3- H++HCO3-
H++HCO3- H++NH3?H2O
H++NH3?H2O H++NH3?H2O
H++NH3?H2O 2NH3(g)△H=-92kJ?mol-1,
2NH3(g)△H=-92kJ?mol-1, 2NH3(g)△H=-92kJ?mol-1;
2NH3(g)△H=-92kJ?mol-1; Ba2+(aq)+SO42-(aq),
Ba2+(aq)+SO42-(aq), Ba2+(aq)+SO42-(aq);
Ba2+(aq)+SO42-(aq); H++HCO3-,故答案为:H2CO3
H++HCO3-,故答案为:H2CO3 H++HCO3-;
H++HCO3-; H++NH3?H2O,故答案为:NH4++H2O
H++NH3?H2O,故答案为:NH4++H2O  H++NH3?H2O;
H++NH3?H2O;

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:


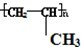
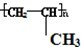


 ;若
;若 在上述类似条件下发生反应,请模仿上例写出该反应的方程式:
在上述类似条件下发生反应,请模仿上例写出该反应的方程式:

查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:查看答案和解析>>
科目:高中化学 来源: 题型:
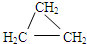 d.CH2=CHCH3.
d.CH2=CHCH3.查看答案和解析>>
科目:高中化学 来源: 题型:
利用天然气合成氨的工艺流程示意图如下:
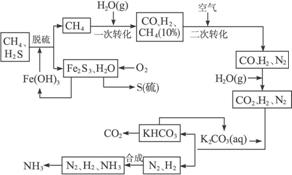
依据上述流程,完成下列填空。
(1)天然气脱硫时的化学方程式是________________。
(2)n mol CH4经一次转化后产生CO 0.9n mol,产生H2________mol。(用含n的代数式表示)
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是__________。(多选扣分)
a.相似相溶原理
b.勒夏特列原理
c.酸碱中和原理
(4)由KHCO3分解得到的CO2可以用于__________ (写出CO2的一种重要用途)。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com