
| A. | 加入Mg能放出H2的溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 存在较多的Fe3+的溶液中:HCO3-、Cl-、SO42- | |
| C. | 水电离产生的c(OH-)=1×10-10 mol/L的溶液中:Al3+、SO42-、NO3-、Cl- | |
| D. | 使甲基橙变红色的溶液中:Na+、AlO2-、NO3-、CO32- |
分析 A.加入Mg能放出H2的溶液,显酸性;
B.离子之间相互促进水解;
C.水电离产生的c(OH-)=1×10-10 mol/L的溶液,为酸或碱溶液;
D.使甲基橙变红色的溶液,显酸性.
解答 解:A.加入Mg能放出H2的溶液,显酸性,该组离子之间不反应,可大量共存,故A正确;
B.Fe3+、HCO3-相互促进水解,不能大量共存,故B错误;
C.水电离产生的c(OH-)=1×10-10 mol/L的溶液,为酸或碱溶液,碱溶液中不能大量存在Al3+,故C错误;
D.使甲基橙变红色的溶液,显酸性,不能大量存在AlO2-、CO32-,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重水解反应、复分解反应的离子共存考查,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
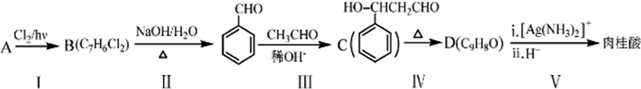

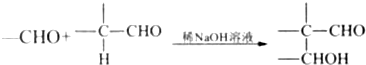
 .
. .肉桂酸的同分异构体中,符合下列条件的有3种,其中在1H核磁共振谱图中出现信号峰数量最少的异构体的结构简式是
.肉桂酸的同分异构体中,符合下列条件的有3种,其中在1H核磁共振谱图中出现信号峰数量最少的异构体的结构简式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②⑤⑥ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将容器容积压缩一半,平衡向右移动,达到新平衡时c(H2)<2mol•L-1 | |
| B. | 向容器中加入0.1molN2,平衡向右移动,达到新平衡时N2的体积分数小于20% | |
| C. | 若达到新平衡时c(H2)=2.5mol•L-1,则改变的条件可能是降温或加压 | |
| D. | 若改变条件后,H2的百分含量增大,则平衡一定向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 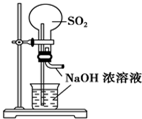 用SO2做喷泉实验 | B. | 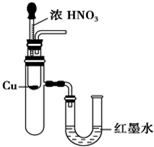 验证CU与浓HNO3反应的热量变化 | ||
| C. | 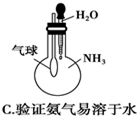 验证氨气易溶于水 | D. | 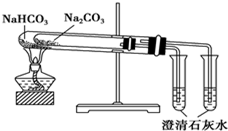 比较Na2CO3与NaHCO3的稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com