
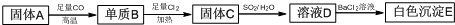
分析 A是铁锈的主要成分是氧化铁,与一氧化碳反应生成单质铁和二氧化碳,铁与氯气反应生成氯化铁,所以固体C为氯化铁,氯化铁与二氧化硫与水反应生成硫酸亚铁,硫酸亚铁溶液中加入氯化钡生成白色沉淀硫酸钡,则E是硫酸钡,由此分析解答.
解答 解:A是铁锈的主要成分是氧化铁,与一氧化碳反应生成单质铁和二氧化碳,铁与氯气反应生成氯化铁,所以固体C为氯化铁,氯化铁与二氧化硫与水反应生成硫酸亚铁,硫酸亚铁溶液中加入氯化钡生成白色沉淀硫酸钡,则E是硫酸钡,
(1)固体A是铁锈的主要成分,化学式Fe2O3,
故答案为:Fe2O3;
(2)一氧化碳还原氧化铁的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,单质B为Fe,铁和氯气发生反应生成固体C为氯化铁,反应的化学方程式为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(3)固体C和二氧化硫水溶液反应生成氯化亚铁、硫酸和盐酸,氯化铁与二氧化硫与水反应生成硫酸亚铁,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,溶液D和氯化钡溶液反应生成白色沉淀硫酸钡,Ba2++SO42-=BaSO4↓,
故答案为:Ba2++SO42-=BaSO4↓.
点评 本题考查铁的单质及化合的相关性质,学生要会分析流程图解相关知识,掌握基础是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯 | B. | 乙醇和丙醇(CH3CH2CH2OH) | ||
| C. | 乙醇和乙醚(C2H5OC2H5) | D. | 甲醛(HCHO)和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
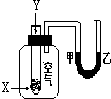 某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )
某学生用如图所示装置进行化学反应X+2Y═2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到U型管中液面甲处降乙处升.关于该反应的下列叙述:①该反应为放热反应;②生成物的总能量比反应物更高;③该反应过程可以看成是“贮存”于X、Y内部的能量部分转化为热量而释放出来.其中正确的是( )| A. | ①②③ | B. | ①③ | C. | ①② | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
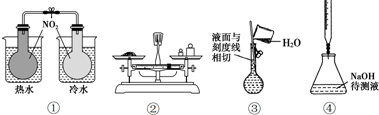
| A. | ①验证温度对平衡移动的影响 | B. | ②称量5.120gNaCl固体 | ||
| C. | ③配制一定物质的量浓度NaCl溶液 | D. | ④中和滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
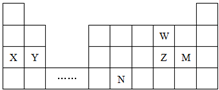
| A. | 原子半径:X>Y>W | |
| B. | 单质的氧化性:W>Z | |
| C. | 溴与元素M同主族,气态氢化物的稳定性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,且K、M层电子数之和等于L层电子数 |
| B | 最外层电子数是次外层电的2倍 |
| C | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4+H2O2+3H2SO4=K2SO4+2MnSO4+4H2O+3O2↑ | |
| B. | 2KMnO4+3H2O2+3H2SO4=K2SO4+2MnSO4+6H2O+4O2↑ | |
| C. | 2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑ | |
| D. | 2KMnO4+7H2O2+3H2SO4=K2SO4+2MnSO4+10H2O+6O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
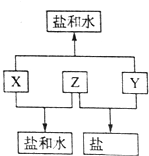 已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题.
已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题.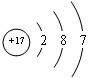 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
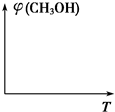 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com