
| A. | C(s、石墨)═C(s、金刚石)△H=+1.9kJ•mol-1 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 石墨的稳定性强于金刚石 | |
| D. | 1mol石墨的总键能比1mol金刚石的总键能小1.9kJ |
分析 先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来解答.
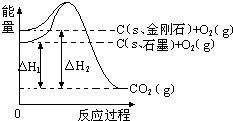
解答 解:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•mol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,则
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol-1,故A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故B错误;
C、金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故C正确;
D、依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol-1,1 mol石墨的总键能比1 mol金刚石的总键能大于1.9 kJ,故D错误;
故选AC.
点评 本题考查热化学方程式的书写及应用,题目难度不大,注意物质的稳定性与能量的关系.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | C的体积分数下降 | ||
| C. | 平衡向逆反应反向移动 | D. | A的转化率变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| B. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| C. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| D. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g 氧气,转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O═2HNO3+NO | |
| B. | 用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3 (胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | C(N2)/mol.L-1 | C(H2)/mol.L-1 | C(NH3)/mol.L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,下层液体从分液漏斗下口放出后再将上层液体从下口放出到另一个烧杯中 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com