
【题目】为确认![]() 、
、![]() 、
、![]() 的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)请据此回答:
的酸性强弱,某学生设计了如下图所示的实验装置,一次实验即可达到目的(不必选其他酸性物质)请据此回答:
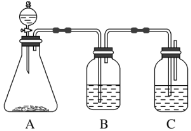
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为________。
(2)装置B所盛的试剂是_____________,其作用是__________________。
(3)装置C所盛试剂是________________,C中反应的离子方程式是____________。
(4)由此得到的结论是酸性:________>________>________。
【答案】盐酸 饱和![]() 溶液 吸收
溶液 吸收![]() 气体
气体 ![]() 溶液
溶液 ![]() ↓
↓![]() (或
(或![]() )
) ![]()
![]()
![]()
【解析】
要确认![]() 、
、![]() 、
、![]() 的酸性强弱,设计的实验流程为HCl→H2CO3→H2SiO3,所以A中反应为2HCl+Na2CO3=2NaCl+H2O+CO2↑,C中反应为Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O==H2SiO3↓+2NaHCO3。由于盐酸易挥发,会干扰CO2与Na2SiO3溶液的反应,所以在反应前,应除去CO2中混有的HCl气体。
的酸性强弱,设计的实验流程为HCl→H2CO3→H2SiO3,所以A中反应为2HCl+Na2CO3=2NaCl+H2O+CO2↑,C中反应为Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O==H2SiO3↓+2NaHCO3。由于盐酸易挥发,会干扰CO2与Na2SiO3溶液的反应,所以在反应前,应除去CO2中混有的HCl气体。
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为酸。
(2)装置B所盛的试剂,应能除去CO2中混有的HCl气体。
(3)装置C中发生反应Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O
==H2SiO3↓+2NaHCO3。
(4)由此可得出酸性的强弱关系。
要确认![]() 、
、![]() 、
、![]() 的酸性强弱,设计的实验流程为HCl→H2CO3→H2SiO3,
的酸性强弱,设计的实验流程为HCl→H2CO3→H2SiO3,
由于盐酸易挥发,会干扰CO2与Na2SiO3溶液的反应,所以在CO2通入硅酸钠溶液前,应除去CO2中混有的HCl气体。
(1)锥形瓶中装某可溶性正盐(通常为Na2CO3)溶液,分液漏斗所盛试剂应为盐酸。答案为:盐酸;
(2)装置B所盛的试剂为饱和NaHCO3溶液,其作用是除去CO2中混有的HCl气体。答案为:饱和![]() 溶液;吸收
溶液;吸收![]() 气体;
气体;
(/span>3)装置C中发生反应Na2SiO3+CO2+H2O==H2SiO3↓+Na2CO3或Na2SiO3+2CO2+2H2O
==H2SiO3↓+2NaHCO3。装置C所盛试剂是![]() 溶液,C中反应的离子方程式是SiO32-+CO2+H2O==H2SiO3↓+CO32-或SiO32-+2CO2+2H2O==H2SiO3↓+2HCO3-。
溶液,C中反应的离子方程式是SiO32-+CO2+H2O==H2SiO3↓+CO32-或SiO32-+2CO2+2H2O==H2SiO3↓+2HCO3-。
(4)由此得到的结论是酸性:HCl>H2CO3>H2SiO3。答案为:HCl;H2CO3;H2SiO3。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】某固体混合物X,含有NaClO3、KCl、NaOH、ZnSO4、NaAl(OH)4和NaNO2中的几种,进行如下实验:①X溶于水,得到溶液Y;②溶液Y先加入过量稀HNO3酸化,再加入AgNO3溶液,得到白色沉淀W,下列说法不正确的是( )
A.混合物X中可能含有KCl
B.向溶液Y中滴加盐酸,若产生白色沉淀,说明X中一定含有NaAl(OH)4
C.向溶液Y中滴加盐酸,若产生红棕色的气体,说明X中一定含有NaNO2
D.取X溶液进行焰色反应,透过蓝色钴玻璃片没有观察到紫色火焰,说明X中一定含有NaClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将A与B的混合物15mol放人容积为2L的密闭容器里,在一定条件下发生反应:2A(g)+3B(g)![]() C(g)+2D(g),经过15min达到平衡,达平衡时容器内的压强是反应前的4/5。则以B气体的浓度变化表示的反应速率是( )
C(g)+2D(g),经过15min达到平衡,达平衡时容器内的压强是反应前的4/5。则以B气体的浓度变化表示的反应速率是( )
A.0.15mol·L-1·min-1 B.0.3mol·L-1·min-1
C.0.45mol·L-1·min-1 D.0.6mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:

①分析可知X为____________(写化学式),0~t1时间段的温度为_________________,0~t1时间段用SO2 表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,lmol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。

①该反应的ΔH_______________0 (填“>”或“<”)。
②计算a点的平衡常数为_______________________。
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为__________________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、工业上制硫酸的主要反应之一为2SO2(g)+O2(g)![]() 2SO3(g),反应过程中能量的变化如图所示。
2SO3(g),反应过程中能量的变化如图所示。
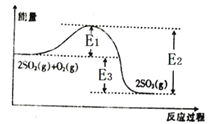
(1)由图可知该反应的正反应为_______(填“吸热”或“放热”)反应。
(2)向反应体系中加入催化剂后,图中E1_____(填“增大”“减小”或“不变”,下同),E3______。
Ⅱ、如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
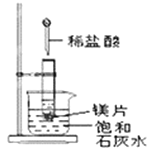
(3)写出试管内反应的离子方程式___________________________;
(4)实验中观察到石灰水中的现象:Ⅰ镁片溶解、Ⅱ镁片上产生大量气泡、Ⅲ_________________,产生上述现象Ⅲ的原因是____________________________。
(5)由实验推知,MgCl2溶液和H2的总能量______(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二醇酯(PET)俗称涤纶树脂,是一种重要的有机高分子材料。其结构为 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:

已知:①![]() ;②
;②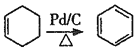 。
。
根据题意回答下列问题:
(1)A的名称是_______,C所含官能团的名称是_______。
(2)由1,3-丁二烯可制备顺式聚1,3-丁二烯,写出顺式聚l,3-丁二烯的结构简式_______。
(3)A→D、B→C的反应类型分别为_______ 、_______。
(4)写出C+F→PET的化学反应方程式______________。
(5)G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3:1:1,则符合该条件的G的同分异构体共有_____种。
(6)参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备丁苯橡胶( )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据vt图分析外界条件改变对可逆反应A(g)+3B(g) ![]() 2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
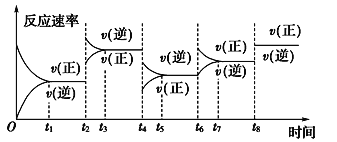
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是
A. 使用了催化剂、增大压强、减小反应物浓度、降低温度
B. 升高温度、减小压强、减小反应物浓度、使用了催化剂
C. 增大反应物浓度、使用了催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。据此判断下列说法正确的是
A. 石墨转变为金刚石的反应是吸热反应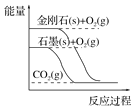
B. 白磷比红磷稳定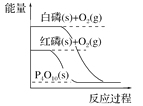
C. S(g)=S(s) ΔH>0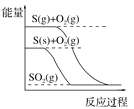
D. H2(g)+I2(g)![]() 2HI(g) ΔH>0
2HI(g) ΔH>0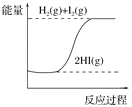
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com