
����Ŀ������Ҫ���������ʵ�顣(a��bΪ���ͼУ�����װ����ȥ)
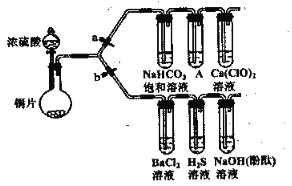
I��֤SO2���������ԡ���ԭ�Ժ������������ͨ�ԡ�
(1) �������������װ�������ԡ���ҩƷ��b (�ر�a)��Ȼ�����Ũ���ᣬ���ȡ�װ��Ũ���������������___________��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ��___________ ��
(2) ����֤SO2���������Ե�ʵ��������__________________________________________��
(3) װ��BaCl2��Һ���Թ������κ�������ֳ����ݣ��ֱ�μӰ�ˮ����ˮ����������ɫ�����������Ļ�ѧʽ�ֱ���___________��___________��д������SO2��ʾ��ԭ�Բ����ɰ�ɫ�������ܵ����ӷ���ʽ____________________________________________��
(4) ����֤SO2���������������ͨ�Ե�ʵ��������________________________________�� ��ͨ�������SO2���仯ѧ����ʽ��____________________________________________��
II��֤���Ե����ǿ����̼��>�����ᡣ(��֪���ԣ�������>̼��)
(5) ��a�ر�b��װ��A�е��������Լ���___________�����ø�װ���ܷ��ж�̼������Աȴ�����ǿ��������_______________________________________________________��
���𰸡���Һ©�� Cu+2H2SO4��Ũ��![]() CuSO4+ SO2��+2H2O װ��H2S��Һ���Թܱ���� BaSO3 BaSO4 Ba2++SO2+Cl2+2 H2O=BaSO4��+4H++2Cl- װ���������ƣ���̪����Һ���Թ�����Һ��ɫ SO2+NaOH=NaHSO3 ���Ը��������Һ �ܣ�ʢ�д��������Һ���Թܱ����
CuSO4+ SO2��+2H2O װ��H2S��Һ���Թܱ���� BaSO3 BaSO4 Ba2++SO2+Cl2+2 H2O=BaSO4��+4H++2Cl- װ���������ƣ���̪����Һ���Թ�����Һ��ɫ SO2+NaOH=NaHSO3 ���Ը��������Һ �ܣ�ʢ�д��������Һ���Թܱ����
��������
��1����Һ©����װ��Ũ���ᣬŨ������ͭ���ȷ�Ӧ��������ͭ�����������ˮ��
��2����������������H2S��Һ�����·�Ӧ�����ɻ�ɫ�������ʣ���ˮ֤������������������ԣ�
��3����������Ϊ����������백ˮ��Ӧ����������泥�����������Ȼ�����Ӧ�������ᱵ������ˮ���������ᣬ�������Ȼ�����Ӧ�������ᱵ��
��4��������������������������Һ��Ӧ�������������ƣ�
��5����a�ر�b����ʵ�����ڱȽ������ᡢ̼��ʹ�������������ǿ����
��1����ʵ��װ��ͼ��֪����Һ©����װ��Ũ���ᣬŨ������ͭ���ȷ�Ӧ��������ͭ�����������ˮ����Ӧ�Ļ�ѧ����ʽΪCu+2H2SO4��Ũ��![]() CuSO4+ SO2��+2H2O���ʴ�Ϊ����Һ©����Cu+2H2SO4��Ũ��
CuSO4+ SO2��+2H2O���ʴ�Ϊ����Һ©����Cu+2H2SO4��Ũ��![]() CuSO4+ SO2��+2H2O��
CuSO4+ SO2��+2H2O��
��2��������������Ԫ�صĻ��ϼ���+4�ۣ����������ԣ���������������H2S��Һ�����·�Ӧ�����ɻ�ɫ�������ʣ���ˮ����Ӧ�ķ���ʽΪ��2H2S+SO2�T3S��+2H2O���ʴ�Ϊ��װ��H2S��Һ���Թܱ���ǣ�
��3����������Ϊ����������백ˮ��Ӧ����������泥�����������Ȼ�����Ӧ���������ᱵ������SO2���л�ԭ�ԣ�����ˮ��Ӧ������������ᣬ�������Ȼ�����Ӧ�������ᱵ��������Ӧ�����ӷ���ʽΪBa2++SO2+Cl2+2 H2O=BaSO4��+4H++2Cl-���ʴ�Ϊ��BaSO3��BaSO4��Ba2++SO2+Cl2+2 H2O=BaSO4��+4H++2Cl-��
��4����������Ϊ���������������������������������Һ��Ӧ�������������ƣ���Һ��ɫ��ȥ����Ӧ�Ļ�ѧ����ʽΪSO2+NaOH=NaHSO3���ʴ�Ϊ��װ���������ƣ���̪����Һ���Թ�����Һ��ɫ��SO2+NaOH=NaHSO3��
(5) ��a�ر�b����ʵ�����ڱȽ������ᡢ̼��ʹ�������������ǿ������������������ǿ��̼�ᣬ��Ӧ���ɵĶ���������̼��������Һ��Ӧ���ɶ�����̼���壬��Ӧ���ɵĻ������ͨ��ʢ�����������Ը��������Һ���Թܳ�ȥ�����������壬������̼��������������Һ��Ӧ����̼��ư�ɫ��������Һ����ǣ�˵��̼�������ǿ�ڴ����ᣬ�ʴ�Ϊ�����Ը��������Һ���ܣ�ʢ�д��������Һ���Թܱ���ǡ�


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д� Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯīϩ����ص���Ʊ�Fe(OH)2��װ����ͼ��ʾ����طŵ�ʱ�ķ�ӦΪ16Li+xS8==8Li2Sx(2��x��8)�������������Ϸֱ�ΪFe��ʯī������һ��ʱ����Ҳಣ�����в��������İ�ɫ����������˵������ȷ����
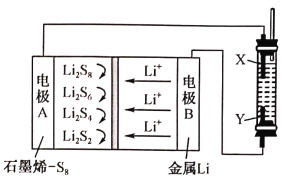
A. X�����缫������������Ӧ
B. ���������ķ���B��Y��X��A
C. �����ɷ�����Ӧ��2Li2S6+2Li++2e��=3Li2S4
D. ﮵缫����0.14gʱ����������Һ����0.18g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ÿ��ݷ��������������ſ�Ԥ���л�����������ʡ�
�����л������У�����H2�����ӳɷ�Ӧ����______(����ĸ)��
a��CH3Cl��������������b��CH2��CH2����������c��CH3CH2OH
�����л������У��ܷ���ˮ�ⷴӦ����______(����ĸ)��
a������ b������ c���Ҵ�
�������л�����������ˮ����______(����ĸ)��
a����ϩ b���������� c��������
�Ʊ��״���![]() ����һ��Ҫ���л�����ԭ�ϣ���һ�������¿ɷ������·�Ӧ��
����һ��Ҫ���л�����ԭ�ϣ���һ�������¿ɷ������·�Ӧ��
2![]() ��O2
��O2![]() 2
2![]() ��2H2O
��2H2O
�ٱ��״��ķ���ʽΪ______��
�ڱ��״������������ŵ�������______��![]() �����������ŵ�������______��
�����������ŵ�������______��
�۱��״��������Ҵ����ƣ����������в����뱽�״���Ӧ����______(����ĸ)��
a��NaOH b��Na c������
�ܸ÷�Ӧ�ķ�Ӧ������______(����ĸ)��
a���ӳɷ�Ӧ b��������Ӧ c��������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܺϽ����Բ�Ϊ�����ܶ�Ԫ�Ͻ��ڸ����£������ܿ������ܣ��������Ϊ�������������ܺϽ���Լ�ǿ�����ȶ��Խϸߣ��ͻ�ѧ��ʴ�Ժܺã���Ҫ���ں��캽���DZ��������ӱ����ſعܵȡ�
��1����̬��ԭ�ӵļ۵����Ų�ͼΪ___________��
��2�����ȶ���ऺϲ�����Pt2+��Cl������ऽ���γɵIJ�������˳ʽ�ͷ�ʽ����ͬ���칹��(����ͼ)����ѧ�о�������˳ʽ���Ӿ��п������ԡ�

����ष����Ǵ����ƽ�����壬��ṹ��ʽ��ͼ��ʾ![]() ��ÿ����ष����к��е�������ĿΪ___________����ष����������ĸ�Ԫ�صĵ縺���ɴ�С��˳����___________��
��ÿ����ष����к��е�������ĿΪ___________����ष����������ĸ�Ԫ�صĵ縺���ɴ�С��˳����___________��
�ڶ��ȶ���ऺϲ��д��ڵ�������������___________(����ĸ)��
a.���»��� b.��� c.������ d.�Ǽ��Լ�
�۷�ʽ���ȶ���ऺϲ�������___________(����Է��ӡ��Ǽ��Է��ӡ�)��

��3��ij�о�С�齫ƽ���͵IJ��������ӽ��в�״������ʹÿ�������еIJ�ԭ����ijһ���������г��У������ܵ���������ӽ���������ṹ����ͼ��ʾ��
�������ӽ��������Ե��磬����Ϊ___________���������еĽ���ԭ����������
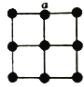
�������ӽ������У���ԭ���Ƿ���sp3�ķ�ʽ�ӻ�?_________(��ǡ���)����������_______��
��4�������������У���ԭ�ӵ���λ��Ϊ12��������������x��y��z���ͶӰͼ��ͼ��ʾ�������������ܶ�Ϊdg��cm��3��������a=______nm(�м���ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� NA��ʾ�����ӵ�������ֵ������˵����ȷ����(������

A. 18g ��(ͼ�ף��к� O��H ����ĿΪ 4NA
B. 28g �����(ͼ�ң��к��ЦҼ���ĿΪ 4NA
C. 44g �ɱ�(ͼ�����к��� 0.25NA�������ṹ��Ԫ
D. ʯīϩ(ͼ������̼ԭ�ӵ���Ƭ״�²��ϣ�12 gʯīϩ�к��Ҽ���ĿΪ 3 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ƶij������ϼ�Ϊ��3�ۣ��ҹ��̲��ŷḻ�ĺ��ƿ�ʯ(Y2FeBe2Si2O10)����ҵ��ͨ�������������̿ɻ�������ơ�

��֪���ٸ��������йؽ��������γ������������ʱ��pH���±���
���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
Fe3�� | 2.1 | 3.1 |
Y3�� | 6.0 | 8.2 |
����Ԫ�����ڱ��У���Ԫ�غ���Ԫ�ش��ڵڶ����ں͵������ڵĶԽ���λ�ã���ѧ�������ơ�
(1)д��Na2SiO3��һ����;________________________��
(2)����Na2SiO3��Na2BeO2�����Һ���Ƶ�Be(OH)2������
�� ���ѡ�������_______�����Լ�����ͨ����Ҫ�IJ�������ʵ�֡�
A��NaOH��Һ B����ˮ C��CO2 D��HNO3
�� д��Na2BeO2���������ᷢ����Ӧ�����ӷ���ʽ___________________________��
(3)�����£���ӦFe3����3H2O(g) ![]() Fe (OH)3����3H+��ƽ�ⳣ��K= ______��ΪʹFe3��������ȫ���ð�ˮ����pH��aʱ��aӦ������_________��Χ�ڣ������Ӱ�ˮ����pH =b������Ӧ�����ӷ���ʽΪ____________________________��
Fe (OH)3����3H+��ƽ�ⳣ��K= ______��ΪʹFe3��������ȫ���ð�ˮ����pH��aʱ��aӦ������_________��Χ�ڣ������Ӱ�ˮ����pH =b������Ӧ�����ӷ���ʽΪ____________________________��
(4)���ղ�����ʱ�����ֽⷴӦ����������Ϊ�����ƣ����������ʹ����ʯ��ˮ����ǡ�д��������[Y2(C2O4)3��nH2O]���յĻ�ѧ����ʽ___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C����3��Ԫ�ء�����գ�
��1��A��ԭ�ӵ�3p�����ֻ��1�����ӵ������������������ӵ����������෴��д����ԭ�Ӽ۵��ӵĹ����ʾʽ��_______________________________����������˶�״̬��_______�֡�
��2��B��ԭ������Ϊ35��Ԫ�أ���ԭ������___________�����Ӳ㣬��_________���ܼ���
��3��CԪ�ػ�̬ԭ�ӵ�M��ȫ������N��û�гɶԵ��ӣ�ֻ��һ��δ�ɶԵ��ӣ�ԪC�ػ�̬ԭ�ӵĵ����Ų�ʽΪ_________________���䵥����һ������������Ũ���ᷴӦ����д���÷�Ӧ����ʽ:____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧʵ��(�г�װ��δ����)���ܴﵽʵ��Ŀ�ĵ���
A. ʵ��ף�CuSO4��Һ�л��γ�һ��������ͨ·
B. ʵ���ң��Թ�����Һ��Ϊ��ɫ
C. ʵ�������ʪ�����ɫ��������ʢ�и���������ƿ�У���������ɫ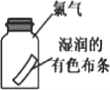
D. ʵ�鶡������������ɫ��ͭ˿������ˮ�Ҵ���ͭ˿����Ϻ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��̶�������ܱ������з�����ӦM(g)+N(g)![]() 2W(g)����˵���÷�Ӧһ���ﵽƽ����ǣ� ��
2W(g)����˵���÷�Ӧһ���ﵽƽ����ǣ� ��
A.v(W)����=v(W)����B.v��=v��=0
C.��������������������D.n(M)��n(N)��n(W)=1��1��2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com