
| A. | 乙烯、苯、环己烷都属于脂肪烃 | B. | 苯、环戊烷、环己烷同属于芳香烃 | ||
| C. | 乙烯、乙炔同属于烯烃 | D. |  、 、 、 、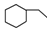 同属于环烷烃 同属于环烷烃 |
分析 A.含有苯环只有C和H两种元素构成的化合物属于芳香烃;
B.只由C和H两种元素组成,含有苯环的为芳香烃;
C.乙炔中含有碳碳三键,属于炔烃;
D.饱和环烃为环烷烃,据此解答即可.
解答 解:A.含有苯环且只有C和H两种元素构成的化合物属于芳香烃,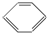 属于芳香烃,不是脂肪烃,故A错误;
属于芳香烃,不是脂肪烃,故A错误;
B.只由C和H两种元素组成,含有苯环的为芳香烃,环戊烷、环己烷不含有苯环,不属于芳香烃,属于脂肪烃,故B错误;
C.乙炔中含有碳碳三键,属于炔烃,故C错误;
D.饱和环烃为环烷烃, 、
、 、
、 同均属于环烷烃,故D正确.
同均属于环烷烃,故D正确.
故选D.
点评 本题主要考查的有机物的分类,熟练掌握各种有机物的代表物,熟记各种物质的官能团是解决本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 增大压强 | B. | 升高温度 | C. | 增大CH4浓度 | D. | 更换高效催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
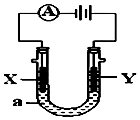 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1+△H2=△H | |
| B. | I-是H2O2分解反应的催化剂 | |
| C. | 欲分解2 mol H2O2(l),至少需要提供98 kJ的热量 | |
| D. | 若生成1 mol O2,则反应ii转移电子的物质的量为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物 | |
| B. | 用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl会升华 | |
| C. | SO2气体和Cl2均能使品红溶液褪色,说明两者均有强氧化性 | |
| D. | 浓硫酸不能用来干燥HI、CO、SO2等气体,因为浓硫酸具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
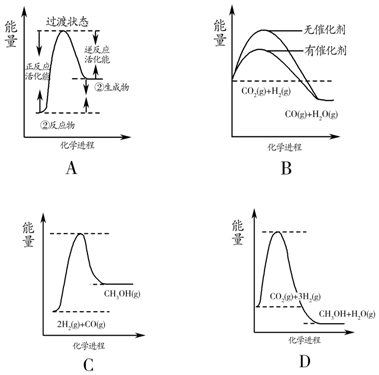
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
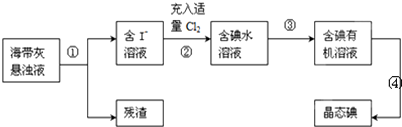
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com