
在一体积为10 L的容器中,通过一定量的CO和H2O,850 ℃时发生反应:
CO(g)+H2O(g)CO2(g)+H2(g)
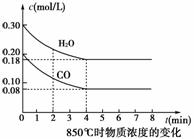
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=________mol·L-1·min-1。
(2)如图中4~5 min之间该反应________(填“是”或“否”)处于平衡状态,判断理由_______________________________________________________________。
科目:高中化学 来源: 题型:
下列对有关实验事实的解释正确的是
A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+
B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同
C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42
D.常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列物质的电离方程式如下:
HClO4===H++ClO ;
;
Ba(OH)2===Ba2++2OH-;
Fe2(SO4)3===2Fe3++3SO ;
;
KHSO4===K++H++SO 。
。
属于酸的物质是________(写化学式,下同);属于碱的物质是________;属于盐的物质是________。
(2)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是____________________。
②上述物质中既不是电解质也不是非电解质的是____________________。依据是____________________________。
③写出纯碱的电离方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在实验室中进行如下实验:
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |
|
|
|
| 现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝色 | 有无色气体放出 |
以下结论正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为CuCl2
C.Ⅲ中的离子方程式为2H++Zn===Zn2++H2↑
D.Ⅲ中发生的反应不是离子反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述中正确的是( )

A.反应的化学方程式为:2MN
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
发射卫星的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后产生的高温气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射现场看到喷出大量红烟,产生红烟的原因是( )
A.高温下氮气遇空气生成NO2
B.CO2与NO反应生成CO和CO2
C.NO与空气生成NO2
D.NO与H2O反应生成H2和NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫中的硫元素是+4价,它既具有氧化性,又具有还原性。现有下列试剂:①KMnO酸性溶液;②氢氧化钠溶液;③品红溶液;④硫化氢溶液;⑤稀硫酸。
(1)要证明二氧化硫的还原性,应选用的试剂是______,看到的现象:
________________________________________________________________________。
(2)要证明二氧化硫的氧化性,应选用的试剂是______,看到的现象:___________。
写出反应的化学方程式_________________________________________________
________________________________________________________________________。
(3)要证明二氧化硫的漂白性,应选用的试剂是______,看到的现象:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c | 电解法,反应为2Cu + H2O |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1
C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
 Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生的热化学方程式是: __ ▲ ___
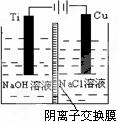
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米 Cu2O,装置如右图所示:该电池的阳极反应式为 __ ▲ ___
钛极附近的pH值 __ ▲ ___ (增大、减小、不变)
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 ▲ ___
 (4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验: △H>0。水蒸气的浓度随时间t变化如下表所示。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验: △H>0。水蒸气的浓度随时间t变化如下表所示。
| 序号 |
| 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 __ ▲ ___ (填字母)。
A.实验的温度:T2<T1 B.实验②比实验①所用的催化剂催化效率高
C.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com