
【题目】如图所示的装置中,M为铁棒,N为石墨棒。关于此装置的下列叙述中,不正确的是( )
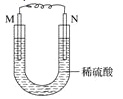
A.M为负极,N为正极
B.N上发生的反应为2H++2e=H2↑
C.M上发生的反应为Fe-3e-=Fe3+
D.溶液中的硫酸根离子向M移动
科目:高中化学 来源: 题型:
【题目】请根据电解饱和食盐水的实验内容填写:
(1) 阳极与电源的__极(选填正或负)相连;阳极产生_(填化学式)气体;它的检验方法是__。
(2)阳极发生___反应;阴极发生__反应(选填氧化或还原)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,有机化合物 Y 可发生重排反应:
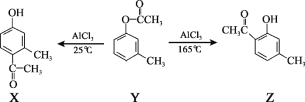
下列说法不正确的是( )
A.X、Y、Z互为同分异构体
B.1 mol X最多能与3 mol H2发生加成反应
C.1 mol Y最多能与2 mol NaOH发生反应
D.通过调控温度可以得到不同的目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,有机化合物 Y 可发生重排反应:
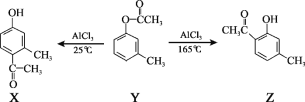
下列说法不正确的是( )
A.X、Y、Z互为同分异构体
B.1 mol X最多能与3 mol H2发生加成反应
C.1 mol Y最多能与2 mol NaOH发生反应
D.通过调控温度可以得到不同的目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合液中逐滴加入稀盐酸,生成气体的量随稀盐酸加入量的变化关系如图,则下列离子组在对应的溶液中一定能大量共存的是
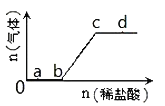
A.a点对应的溶液中:Ca2+、Mg2+、Br-、NO3-
B.b点对应的溶液中:Al3+、Fe3+、MnO4-、NO3-
C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如下图所示:用离子方程式表示海水呈弱碱性的原因_________。己知春季海水pH=8.1,预测夏季海水碱性将会_________(填写“增强”或“减弱”),理由是________(写出1条即可)
无机碳 | HCO3- | 90% |
CO32- | 9% | |
CO2 | 1% | |
H2CO3 | ||
其中H2CO3仅为CO2的0.2% | ||
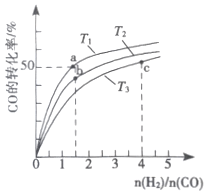
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g) ![]() CH3OH(g) △H<0,在容积为1L 的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的 起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是_________(a、b点横坐标相同,a在曲线T1上,b在曲线T2上)
CH3OH(g) △H<0,在容积为1L 的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的 起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是_________(a、b点横坐标相同,a在曲线T1上,b在曲线T2上)
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点(1.5,50)状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
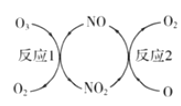
①NO的作用是__________________。
②己知:O3(g)+O(g)=2O2(g) △H =-143kJ·mol-1
反应 1: O3(g)+NO(g) ![]() NO2(g)+O2(g) △H1=-200.2kJ·mol-1
NO2(g)+O2(g) △H1=-200.2kJ·mol-1
反应2:热化学方程式为______________________。
(4)近年来,地下水中的氮污染己成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用 下,密闭容器中的H2可髙效转化酸性溶液中的硝态氮(NO3-)从而降低水体中的氮含量,其工作原理如下图所示
①Ir表面发生反应的方程式为__________________________。
②若导电基体上的Pt颗粒增多,造成的后果是__________________________。

(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示,甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II附近发生的电极反应式为__________________________。
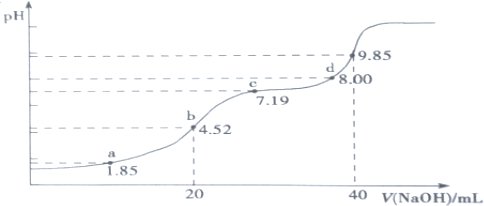
(6)大气污染物SO 2可用NaOH吸收。已知pKa=-lgKa,25℃时,H2SO3 的 pKa1=1.85, pKa2=7.19。该温度下用 0.1mol·L-1NaOH溶液滴定 20mL0.1mol·L-1H2SO3溶液的滴定曲线如下图所示。b点所得溶液中各离子浓度由大到小的顺序是__________________________;c点所得溶液中:c(Na+)__________3c(HSO3-)(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)并进行相关实验(装置如图),电解一段时间后,各部分装置及对应的现象为:(1)中黑色固体变红;(2)电极a附近溶液出现浑浊;(3)中溶液出现浑浊;(4)中溶液红色褪去。下列对实验现象解释不正确的是
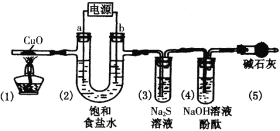
A.(1)中:CuO+H2![]() Cu+H2O
Cu+H2O
B.(2)中a电极:2H2O+2e-=H2↑+2OH-,Mg2++2OH-=Mg(OH)2↓
C.(3)中:Cl2+S2-=S↓+2Cl-
D.(4)中:Cl2具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功合成了世界上首个含五氮阴离子的盐(局部结构如图),其中还有两种10电子离子、一种18电子离子。X、Y、Z、M为原子序数依次增大的短周期元素,且均不在同一族。下列说法不正确的是( )
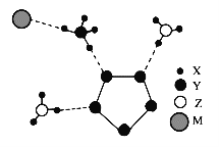
A.Y的原子半径大于Z的原子半径
B.在该盐中,存在极性共价键和非极性共价键
C.Z的简单气态氢化物稳定性比Y的简单气态氢化物稳定性强
D.Y的最高价氧化物对应水化物的酸性比M的最高价氧化物对应水化物的酸性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下工业流程制备无机功能材料MnO2,粗MnO2的提纯是工业生产的重要环节,某研究性学习小组设计了将粗MnO2(含有较多MnO和MnCO3)样品转化为纯MnO2实验。
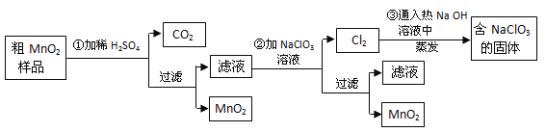
针对上述工业流程,下列选项错误的是( )
A.第①步加稀![]() 时,粗MnO2样品中的MnO、MnCO3转化为可溶性物质
时,粗MnO2样品中的MnO、MnCO3转化为可溶性物质
B.不考虑操作过程中的损失,本流程中的![]() 固体能全部循环,不需额外补充
固体能全部循环,不需额外补充
C.第②步反应的离子方程式![]()
D.实验室模拟上述工业流程中得到MnO2固体的操作必须用到的玻璃仪器有玻璃棒、烧杯、漏斗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com