
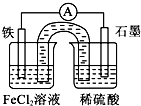
| A、原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大 |
| B、Fe为负极,发生的反应为:Fe-3e-=Fe3+ |
| C、Fe为正极,石墨上发生的反应为:2H++2e-═H2↑ |
| D、原电池装置中的盐桥完全可用金属导线代替 |


科目:高中化学 来源: 题型:
| A、升高温度,正、逆反应速率都增大,平衡向逆方向移动 |
| B、减少压强,逆反应速率增大,正反应速率减少,平衡向逆方向移动 |
| C、移去部分SO3,正反应速率增大,逆反应速率减少,平衡向正方向移动 |
| D、加入催化剂,正、逆反应速率都增大,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时,物质的量之比n(A):n(B):n(C)=2:11:4 |
| B、x值等于3 |
| C、A的转化率为20% |
| D、B的平均反应速率为0.4 mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg?L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液 |
| B、图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝 |
| C、用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
| D、用装置④可进行铁片镀锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔质量:g |
| B、气体摩尔体积:L?mol-1 |
| C、密度:g?mL-1 |
| D、物质的量浓度:mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com